

| 编 号 | 实验一 | 实验二 |
| 反应前/g | 118.4 | 112.6 |
| 反应后/g | 118.4 | 112.4 |
分析 【设计并实验】铜与氧气反应生成了氧化铜,所以可以判断在加热前后铜棒不能再保持平衡,可以据此解答该题.
【分析与讨论】
(1)化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)实验二所发生的反应中有气体生成,且容器是敞口的,所以反应前后B瓶中的质量不再相等,实验三有空气中的氧气参加反应,可以据此解答该题;【实验反思】根据如用有气体参与或生成的化学反应来验证质量守恒定律时,反应应在密闭容器中进行才能判定总质量是否相等解答;
解答 解:
【设计并实验】右端的铜在加热的条件下与氧气反应生成了氧化铜,所以可以判断在加热前后铜棒不能再保持平衡.铜棒向有酒精灯加热的一端向下倾斜.
【分析与讨论】
(1)硫酸铜和铁反应生成铜和硫酸亚铁,参加反应的物质的质量之和,等于反应后生成的物质的质量之和,故实验一正确反映了反应物与生成物之间的质量关系,因为化学反应前后,原子的种类、数目、质量不变;
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,导致这一结论错误的原因是:实验二镁条和稀硫酸反应产生的氢气逸散到空气中,实验三有空气中的氧气参加反应;
【实验反思】如用有气体参与或生成的化学反应来验证质量守恒定律时,反应应在密闭容器中进行才能判定总质量是否相等.
答案:
【设计并实验】铜棒向有酒精灯加热的一端向下倾斜
【分析与讨论】(1)一 化学反应前后,原子的种类、数目、质量不变
(2)实验二镁条和稀硫酸反应产生的氢气逸散到空气中或者实验三有空气中的氧气参加反应
【实验反思】密闭装置
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.


 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:选择题
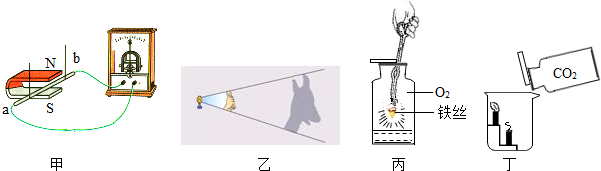
| A. | 甲实验说明发电机的原理是电磁感应 | |
| B. | 乙实验说明光在同种均匀介质中沿直线传播 | |
| C. | 丙实验说明铁丝在氧气中燃烧生成氧化铁 | |
| D. | 丁实验说明二氧化碳不燃烧,也不支持燃烧,密度比空气大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中的CO | 通入澄清石灰水中 |
| B | 除去铜粉中的银粉 | 滴加适量稀盐酸 |
| C | 鉴别羊毛和涤纶 | 灼烧并闻气味 |
| D | 比较铁和铜金属的活动性 | 将铁丝插入硫酸铜溶液中(合理即可) |
查看答案和解析>>
科目:初中化学 来源:【全国市级联考】湖北省黄冈市2017届九年级中考模拟B卷化学试卷 题型:选择填充题
下列变化中,一定属于化学变化的是( )
A. 花香四溢 B. 钢铁生锈 C. 瓷碗破碎 D. 空气液化
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
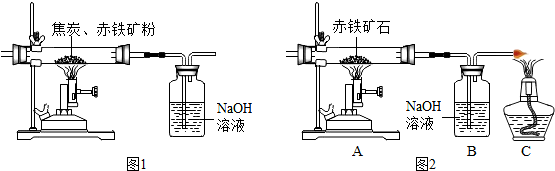
| 实验前 | 实验后 | |
| (赤铁矿粉+玻璃管)的质量/g | 51.60 | 49.68 |
| (NaOH溶液+广口瓶)的质量/g | 158.12 | 162.97 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧产生淡蓝色火焰,生成无色无味的气体 | |
| B. | 把洁净的铜丝插入硫酸铝溶液中,铜丝表面有银白色固体析出 | |
| C. | 打开装有浓盐酸试剂瓶的瓶塞,在瓶口上方观察到白烟 | |
| D. | 硝酸铵固体溶于水会降温 |
查看答案和解析>>
科目:初中化学 来源:江苏省教育集团树人学校2017届九年级下学期第二次模拟考试化学试卷 题型:简答题
为了测定样品CaSO4•XH2O和CaCO3混合物的组成,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
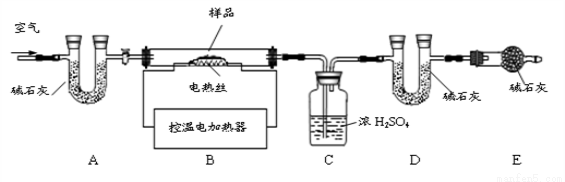
(1)实验前首先要_________,再装入样品。装置A中碱石灰的作用是___________。
(2)C装置的作用是应用了浓硫酸具有___________的性质。
(3)已知CaSO4•XH2O失去全部结晶水的温度为160℃,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验,并采集了如下实验数据:
a.样品的质量为m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
若实验测得m1=22.20 g,m3=3.60 g,m4=2.20 g。
求:①样品中CaCO3的质量___________ g;②X的值_____________。
(4)装置E的作用是_________,若缺少E装置,测得CaCO3的质量___________(选填“偏大”、“偏小”、“不变”),X的值会___________(选填“偏大”、“偏小”、“不变”)。
(5)你认为还可选用下列_________(选填序号)数据组合也可求出X的值。
A.ab B.abd C.bcd
(6)CaSO4当温度达到1350℃时分解会产生一种固体氧化物与两种气体,其中一种气体有刺激性气味,其分解的化学方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com