
 某学习小组探究氢氧化钙溶液的化学性质,并做了延伸探究.
某学习小组探究氢氧化钙溶液的化学性质,并做了延伸探究.| 方案 | (1) | (2) | (3) |
| 实验操作 | 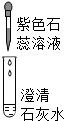 | 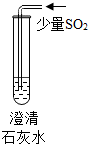 |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 SO2+Ca(OH)2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
分析 探究一:(1)根据碱性溶液能使紫色石蕊溶液变蓝解答;
(2)根据氢氧化钙溶液能与某些非金属氧化物反应生成盐和水解答;
【分析讨论】根据稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性解答;
探究二:根据图示现象分析解答.
【得出结论】根据实验探究得出结论;
【反思讨论】根据碳酸钠和稀盐酸反应,生成氯化钠、水和二氧化碳解答;根据碳酸钠和氯化钙反应,生成碳酸钙沉淀、氯化钠解答.
解答 解:探究一:
(1)澄清的石灰水显碱性,碱性溶液能使紫色石蕊溶液变蓝;
(2)二氧化硫和氢氧化钙反应,生成亚硫酸钙和水,反应的化学方程式是SO2+Ca(OH)2═CaSO3↓+H2O;
【分析讨论】从实验现象分析可知:稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙,故猜想③肯定不合理;
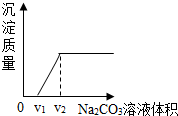
探究二:根据图示现象分析可知:因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,产生气泡,然后再与氯化钙反应,生成的碳酸钙沉淀,溶液最终变红色;
【得出结论】根据实验探究可知:溶液中除含少量酚酞外,溶质有CaCl2和HCl,故②正确;
【反思讨论】碳酸钠和稀盐酸反应,生成氯化钠、水和二氧化碳;碳酸钠和氯化钙反应,生成碳酸钙沉淀、氯化钠,故:
A、不断滴加碳酸钠溶液,溶液质量逐渐增大,故对;
B、若加入Na2CO3溶液的体积为V,当V<V2时,氯化钠的质量逐渐增大;当V≥V2时,反应完全,氯化钠的质量不变,故对;
C、氯化钙的质量逐渐减小,故错;
D、溶液的pH一直在增大,最后不变,故错.
答案:
探究一:溶液变为蓝色;SO2+Ca(OH)2═CaSO3↓+H2O;
【分析讨论】稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙;
探究二:滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.【得出结论】②;【反思讨论】AB.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:实验探究题
 物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) | 溶解,有气泡,溶液呈浅绿色 |
| 2 | 取步骤1所得溶液,滴加KSCN溶液 | 变红 | 无现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.9%Na2SO4溶液(ml) | 0.9%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液 3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
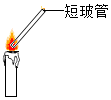 研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧缺有明亮的火焰.该小组同学进行了如下探究:
研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧缺有明亮的火焰.该小组同学进行了如下探究:| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50-70 | 300-550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
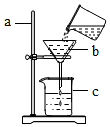 如图所示为过滤的操作实验,请按要求回答下列问题:
如图所示为过滤的操作实验,请按要求回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com