
 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
分析 (1)能够用作保险丝的物质熔点较低;
(2)三种金属的活动性可能是Ti>Mg>Ag;也可能是Mg>Ag>Ti;也可能是Mg>Ti>Ag;
三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的氧化物;
镁和稀盐酸反应生成氯化镁和氢气;
温度越高、反应物浓度越大,反应速率越快.
解答 解:(1)钛合金熔点高,不能用作保险丝.
故填:A.
(2)【提出假设】三种金属的活动性可能是Ti>Mg>Ag;也可能是Mg>Ag>Ti;也可能是Mg>Ti>Ag.
故填:Mg>Ti>Ag.
【实验设计】①三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的氧化物.
故填:除去表面的氧化物.
②镁和稀盐酸反应产生气泡速度快,钛和稀盐酸反应产生气泡速度缓慢,说明镁比钛活泼,银和稀盐酸混合无任何现象,说明银最不活泼;
镁和稀盐酸反应的化学方程式为:Mg+2HCl═MgCl2+H2↑.
故填:C;Mg+2HCl═MgCl2+H2↑.
③则0~t时间内反应速率逐渐加快的主要原因是反应放热,使反应速率加快.
故填:反应放热,使反应速率加快.
④在【实验设计】中,如果所用盐酸的溶质质量分数不同,不一定能够得出正确结论,理由是反应物浓度会影响反应速率.
故填:否;反应物浓度会影响反应速率.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:初中化学 来源: 题型:选择题
| 名称 | 新鲜肉 | 次鲜肉 | 变质肉 |
| pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
| A. | 逐渐变弱 | B. | 保持不变 | C. | 逐渐变强 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
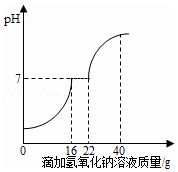 同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量
同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不放出氧气 | B. | 放出氧气的速度慢 | ||
| C. | 放出氧气总量会减少 | D. | 放出氧气总量会减少且速度慢 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 |
| MnO2催化、不加热 | 10 | 25 | 60 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 实验步骤 | 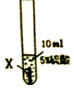 | 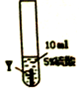 | 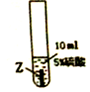 |
| 实验现象 | 在X片表面无明显变化 | Y片表面无明显变化 | Z片溶解,表面有无色氢气产生,溶液最终无色 |
| 实验序号 | ④ | ⑤ |
| 实验步骤 | 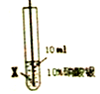 | 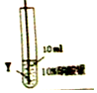 |
| 实验现象 | 在X丝表面有银白色的固体析出 | 在Y丝表面没有明显现象 |
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
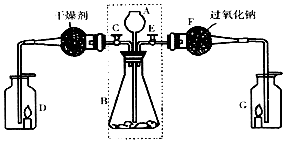
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
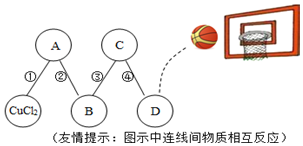
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com