水是重要的自然资源.
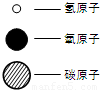
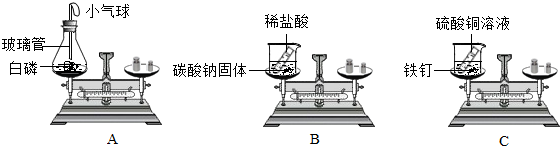
(1)如图所示的3个实验,A中水发生了
物理
物理
(填“物理”或“化学”)变化;B中试管1内得到的气体为
氢气(H2)
氢气(H2)
;C中净化水的方法是
过滤
过滤
和吸附.
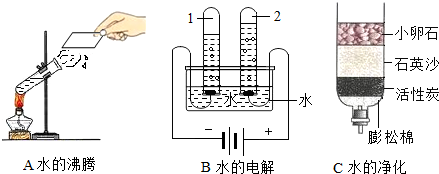
(2)将原水处理成自来水需要加入消毒剂.其中用液氯消毒时发生反应的微观过程如图:
该反应的化学方程式为
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
,D物质中氯元素的化合价是
+1
+1
.
(3)部分地区的天然水中Ca
2+、Mg
2+含量超标,称为硬水,需要软化,即降低Ca
2+、Mg
2+含量.
①煮沸一定程度上可以起到软化作用,因为在煮沸过程中,溶于水中的碳酸氢钙[Ca(HCO
3)
2]会发生如下反应:Ca(HCO
3)
2=CaCO
3↓+CO
2↑+H
2O,若水中含有较多的Ca(HCO
3)
2,煮沸过程中可能观察到的现象是
水变浑浊,有气泡冒出
水变浑浊,有气泡冒出
.
②煮沸不能被软化的硬水通过化学反应进行软化.纯碱(Na
2CO
3)是常用的水软化剂,碳酸钠溶液与水中的氯化钙反应生成碳酸钙和一种生活必需品,反应的化学方程式为
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
.

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案



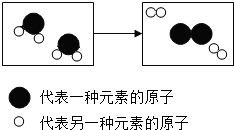
 ”和“
”和“ ”分别表示不同的原子).
”分别表示不同的原子).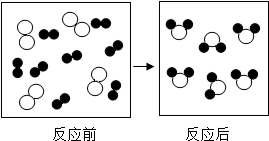
 ”微粒.
”微粒.




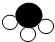




 ”和“
”和“ ”分别表示不同的原子).
”分别表示不同的原子).
 ”微粒.
”微粒.