
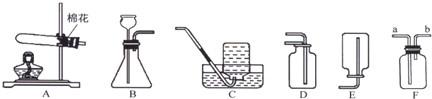
(14分)实验室制取气体的常用装置如下图所示,根据所学的知识回答下列问题。
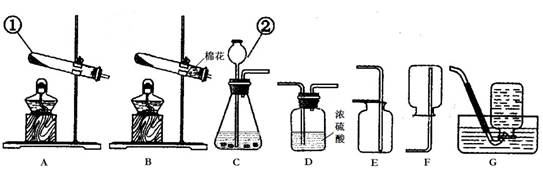
(1)写出装置中标号仪器的名称:① ;② 。
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是 (填字母)。写出该反应的化学方程式: 。
(3)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式: 并据此选择上图中 (填字母)组装一套制取干燥二氧化碳的装置。
(4)小明将实验室制取二氧化碳后的废液静置,取上层清液50g,向其中逐滴加入质量分数为26.5%的碳酸钠溶液。她根据实验测得的数据绘出下图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是加入碳酸钠溶液的质量。试计算:
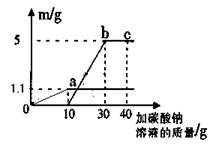
①50g废液中含氯化钙的质量;
②b点表示的溶液中氯化钠的质量分数。
(1)①试管;②长颈漏斗
(2)B; 2KMnO4  == K2MnO4 + MnO2+ O2↑(2分)
== K2MnO4 + MnO2+ O2↑(2分)
(3)CaCO3+ 2HCl === CaCl2 + H2O + CO2↑(2分);CDE(不分先后顺序)
(4)①5.55g ②11.9%
解析:本题前面考察的是实验室制取气体的相关知识,是中考必考内容,需熟记。
由图像可知废液中有盐酸剩余,加入头10克碳酸钠与盐酸反应生成了1.1克二氧化碳,盐酸反应没了,氯化钙与碳酸钠反应生成了5克沉淀,据此就可以算出氯化钙和生成的氯化钠的质量了。
(4)①设氯化钙的质量为X
CaCl2+ Na2CO3= CaCO3↓+2NaCl
111 100
X 5g
111/100=X/5g
解得X=5.55克 (2分)
②CaCl2+ Na2CO3= CaCO3↓+2NaCl
Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
根据质量守恒定律,30g碳酸钠溶液中的钠元素质量和最终反应后的溶液中的氯化钠的钠元素质量是相等的,先求30g碳酸钠溶液中的钠元素的质量为30*26.5%*46/106=3.45g,
则b点时氯化钠的质量为3.45g/(23/58.5)=8.775g
此时溶液的质量为:50g+30g-5-1.1=73.9g
氯化钠的质量分数为8.775g /73.9g *100%=11.9%(1分)


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com