
| A. | 铁 | B. | 铜 | C. | 镁 | D. | 铝 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:解答题
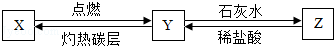
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
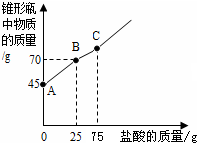 氢氧化钙长期存放容易变质.某科学探究小组在实验时取了一瓶存放多年的氢氧化钙来检验其变质情况.首先取氢氧化钙样品12.2g于锥形瓶中,加入32.8g水,充分振荡形成悬浊液,然后向锥形瓶中逐滴滴加29.2%的盐酸使其充分反应.实验测得加入盐酸的质量与锥形瓶中物质的质量关系如下图所示.
氢氧化钙长期存放容易变质.某科学探究小组在实验时取了一瓶存放多年的氢氧化钙来检验其变质情况.首先取氢氧化钙样品12.2g于锥形瓶中,加入32.8g水,充分振荡形成悬浊液,然后向锥形瓶中逐滴滴加29.2%的盐酸使其充分反应.实验测得加入盐酸的质量与锥形瓶中物质的质量关系如下图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硅 | B. | 锰 | C. | 钨 | D. | 铬和镍 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
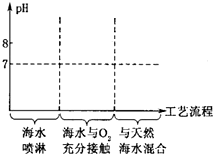 为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:
为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com