
分析 (1)根据化学式的意义分析,化学式能表示组成物质的元素;根据化学式能计算物质中某元素的质量分数,通过比较找出质量分数最大的元素;
(2)根据物质的分类特点分析.
(3)元素的原子个数是指化学式中元素右下角的数字,
(4)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
解答 解:(1)由乙烯利的化学式C2H6ClO3PO3可知,乙烯利是由碳、氧、氢、氯、磷五种元素组成;
根据乙烯利的化学式C2H6ClO3PO3,可知,化学式中碳、氧、氢、氯、磷五种元素的质量比为(12×2):(16×6):(1×6):35.5:31=24:96:6:35.5:31通过对比可知,氧元素的质量最大,则乙烯利中氧元素质量分数最大.
(2)乙烯的化学式C2H4可知,它含有碳元素,属于有机物,当然是纯净物.
(3)乙烯中碳、氢元素的原子个数比为4:2=2:1;
(4)乙烯中碳、氢元素的质量比为(12×2):(1×4)=6:1.
故答案为:
(1)5;氧;(2)纯净物、有机物; (3)2:1(4)6:1.
点评 本题主要考查了化学式的意义及化学式的计算,理解化学式的意义,是进行有关化学式计算的基础.


科目:初中化学 来源: 题型:解答题
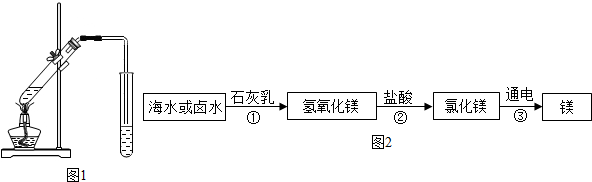
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
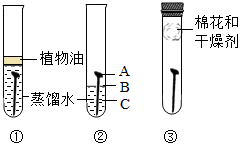 某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
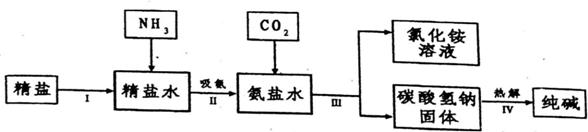
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )
分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面水平),如图所示,放置一段时间后,以下说法错误的是( )| A. | 植物油用于隔绝氧气和水 | |
| B. | a试管中铁片不被腐蚀,b试管中铁片被腐蚀 | |
| C. | U形玻璃管两端液面变为右低左高 | |
| D. | U形玻璃管两端液面变为左低右高 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盐酸使紫色石蕊溶液变成红色 | B. | 氢氧化钠长期置于空气中变质 | ||
| C. | 酒精用于给发烧病人擦拭降温 | D. | 小苏打在做馒头时用作发酵剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+、OH-、SO42-、Cu2+ | B. | CO32-、K+、Cl-、Ca2+ | ||
| C. | H+、Ba2+、Cl-、NO3- | D. | K+、NO3-、Na+、OH- |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com