
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 给定氧气的质量 | 1.5g | 16g | 20g |
| 生成二氧化硫质量 | 3.0g | 32g | 32g |
分析 根据质量守恒定律,若第一次实验16g硫与15g氧气反应,应生成二氧化硫质量=15g+16g=31g,而实际反应中只生成二氧化硫30g<31g说明两种物质未恰好完全反应,有一种物质有剩余;第二次实验16g硫与16g氧气与生成的32g二氧化硫,质量关系恰好与质量守恒定律相符,说明此时反应为恰好完全反应;则第三次实验中氧气质量再增加至20g,因硫不足而氧气剩余.
解答 解:(1)参加反应的各物质质量总和与反应生成物质质量总和相等,符合这一要求的只有第二次实验,所以此次实验中两种物质恰好完全反应;
(2)根据第二次完全反应,说明硫和氧气按1:1的质量比进行反应,16g硫最多可消耗16g氧气,那么第三次氧气有剩余,氧气剩余的质量为:20g-16g=4g;
故答案为:
(1)二.
(2)第三次氧气有剩.
点评 反应物质恰好完全反应,参加反应的反应物质质量总和一定等于生成物质量总和.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
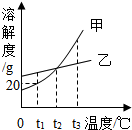
| A. | 甲物质的饱和溶液中含有少量乙,可采用降温结晶的方法分离提纯甲 | |
| B. | 将t2℃时的甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等 | |
| C. | t2℃时,要使接近饱和的乙溶液达到饱和状态,可采用蒸发溶剂的方法 | |
| D. | t1℃时,50g甲的饱和溶液中溶解了10g的甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水是能溶解多种物质的常用溶剂 | B. | 水是由水分子构成的一种氧化物 | ||
| C. | 水汽化时分子间隔发生了变化 | D. | 用明矾溶液可以区分硬水和软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,然后滴加足量的氯化钙溶液 | 产生白色沉淀,滤液变成无色(或滤液仍然是红色的) | 猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其余反应条件、部分反应物已略去.试判断:
如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其余反应条件、部分反应物已略去.试判断:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com