
分析 根据化学反应前后原子的种类及数目不变,据此分析回答有关的问题.根据在化合物中正负化合价代数和为零,结合高铁酸钾的化学式进行解答本题.根据日常生活中使硬水软化的一种常用方法是加热煮沸解答.
解答 解:在化学方程式4K2FeO4$\frac{\underline{\;\;△\;\;}}{\;}$2R+4K2O+3O2↑中,反应物中钾、铁、氧原子个数分别为8、4、16,反应后的生成物中钾、铁、氧原子个数分别为8、0、10,根据反应前后原子种类、数目不变,则2R中含有4个铁原子和6个氧原子,则每个R分子由2个铁原子和3个氧原子构成,则物质R的化学式为Fe2O3.
钾元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价.
日常生活中使硬水软化的一种常用方法是加热煮沸.
答案:Fe2O3;+6;煮沸.
点评 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.


科目:初中化学 来源: 题型:选择题
| A. | 食盐水除去暖水瓶中的水垢 | |
| B. | 发现有人煤气中毒时立即将其移至通风处 | |
| C. | 热的纯碱溶液洗涤餐具上的油污 | |
| D. | 车船表面喷涂油漆以防生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
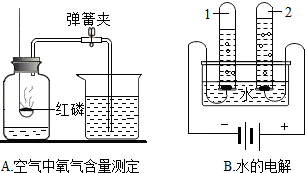 氧气和水是我们身边重要的物质.A、B都是研究物质组成和性质的实验.
氧气和水是我们身边重要的物质.A、B都是研究物质组成和性质的实验.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气加压后变成液氧,是因为分子间的间隔变小 | |
| B. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 | |
| C. | NaOH和Ca(OH)2化学性质相似,因为在水中解离出的阴离子都是OH- | |
| D. | 蔗糖溶液是混合物,因为蔗糖溶液是由不同种分子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
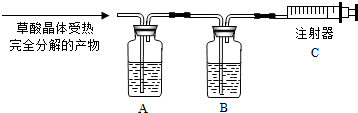
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 20% | B. | 15% | C. | 10% | D. | 无法计算 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
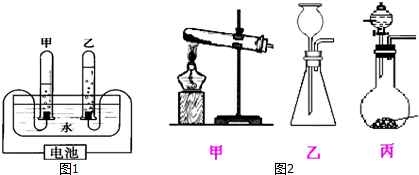
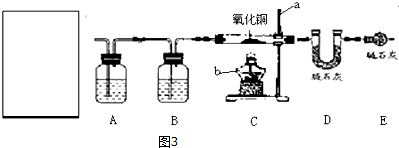
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com