
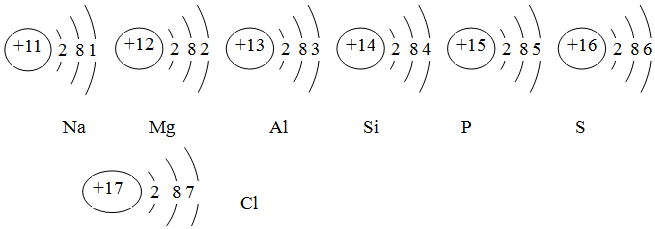
分析 (1)原子中,原子序数=核外电子数=核内质子数,再根据原子结构示意图,可知原子序数为15的原子质子数;
(2)根据原子结构示意图可知:原子序数为13的原子,最外层电子数为3个,为金属元素,易失去最外层电子,而带正电荷;
(3)根据原子序数为12的元素的原子易失去2个电子,带2个正电荷;原子序数为17的元素的原子易得1个电子,带1个负电荷;
(4)根据原子结构示意图可知:从11-17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律.
解答 解:
(1)因为原子序数=核外电子数=核内质子数,所以原子序数为15的原子质子数为15;
(2)根据原子结构示意图可知:原子序数为13的原子,最外层电子数为3个,易失去3个电子,而带3个正电荷,故离子符号为Al3+;
(3)原子序数为12的元素的原子易失去2个电子,带2个正电荷;原子序数为17的元素的原子易得1个电子,带1个负电荷,故原子序数为12、17的元素组成化合物的化学式MgCl2;
(4)根据原子结构示意图可知:呈现出的变化规律为:最外层电子数从1递增到7.
故答案为:
(1)15;
(2)Al3+;
(3)MgCl2
(4)最外层电子数从1递增到7.
点评 本题主要考查原子结构示意图的意义,由题目给出信息,推断该元素的原子构成,对于原子构成的一些规律应当熟记;掌握化学符合及其周围的数字的意义.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中混有氯化铜(铁粉) | B. | 铜粉中混有铁粉(磁铁) | ||
| C. | O2中混有CO2(NaOH溶液) | D. | CuSO4中混有NaCl(AgNO3溶液) |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 两种白色固体 | 主要操作、现象和结论 |
| 碳酸钙、氧化钙 | 分别将两种固体加水溶解,难溶于水的是碳酸钙,与水剧烈反应且有热量放出的是氧化钙 |
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
| 溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com