

 解得X=
解得X= g,所以氯化钙的质量分数为
g,所以氯化钙的质量分数为 =
=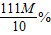 ;
; =80g,需要水:80g-8g=72g.
=80g,需要水:80g-8g=72g.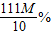 ;(4)CaCO3+2HCl=CaCl2+H2O+CO2↑;(5)72.
;(4)CaCO3+2HCl=CaCl2+H2O+CO2↑;(5)72.

科目:初中化学 来源: 题型:
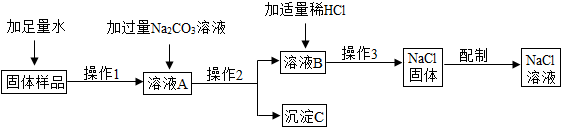
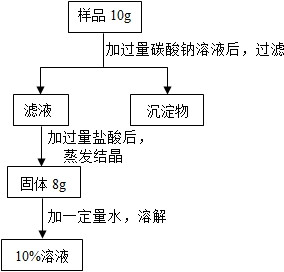 (2012?昆山市一模)用含有少量氯化钙的氯化钠固体,配制质量分数为10%的氯化钠溶液,设计如图所示操作方案,根据右图回答:
(2012?昆山市一模)用含有少量氯化钙的氯化钠固体,配制质量分数为10%的氯化钠溶液,设计如图所示操作方案,根据右图回答:| 111M |
| 10 |
| 111M |
| 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:
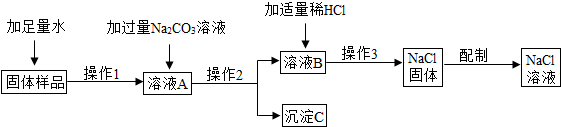
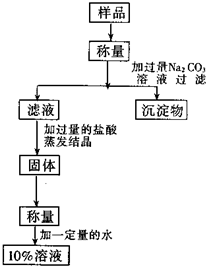 用含有少量氯化钙的氯化钠固体配置溶质的质量分数为10%的氯化钠溶液,设计如图所示操作方案.请回答:
用含有少量氯化钙的氯化钠固体配置溶质的质量分数为10%的氯化钠溶液,设计如图所示操作方案.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
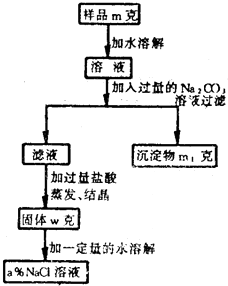 欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案.根据方案中所示回答下列各问:
欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案.根据方案中所示回答下列各问:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com