
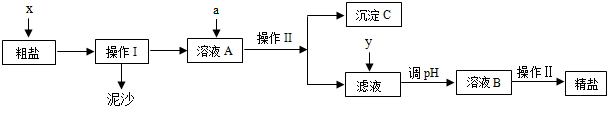
分析 (1)根据粗盐的提纯需要将其配成溶液才能进行;
(2)根据NaOH溶液能与氯化镁溶液反应生成氢氧化镁白色沉淀,BaCl2溶液能与Na2SO4溶液反应生成硫酸钡白色沉淀,碳酸钠溶液能与氯化钙溶液反应生成碳酸钙白色沉淀,碳酸钠溶液能与过量的氯化钡溶液反应生成碳酸钡白色沉淀,盐酸能与过量的氢氧化钠、碳酸钠溶液反应,进行分析解答.
(3)分离固体与溶液的方法是过滤,食盐通过蒸发结晶析出,
(4)根据(2)的结果分析判断;还有氯化钡和碳酸钠过量了;
(5)加入适量HCl(除去过量NaOH,Na2CO3);
(6)在提纯过程中生成了氯化钠;过量的氢氧化钠和碳酸钠用盐酸来调节pH,也生成氯化钠;
(7)用洗净的玻璃棒蘸取少量该溶液,然后滴在一小张pH试纸上,与标准比色卡比较.
解答 解:(1)海水晾晒得到的粗盐是固体,要进行提纯,需要先配成溶液;
(2)碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,因此加入Na2CO3溶液的目的是除去溶液中的钙、钡离子;氯化钡溶液和碳酸钠溶液的顺序不能颠倒,若颠倒会引入新的杂质氯化钡.
(3)分离固体与溶液的方法是过滤,I、II都是分理处沉淀的过程.食盐通过蒸发结晶析出,操作Ⅲ是蒸发操作,操作Ⅱ和操作Ⅲ都要用到的仪器有玻璃棒和铁架台;
(4)根据(2)可知沉淀的成分有:BaSO4、CaCO3.另外还有氯化钡和碳酸钠过量,所以碳酸钠溶液和氯化钡溶液反应,还会生成氯化钠和碳酸钡沉淀.
(5)加入适量HCl调节pH的目的是除去过量NaOH,Na2CO3;
(6)在粗盐提纯的过程中,在提纯过程中生成了氯化钠.所以实验所得精盐的质量大于粗盐中NaCl的质量.
整个过程中产生新的NaCl的反应共有:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
BaCl2+Na2SO4═BaSO4↓+2NaCl.BaCl2+Na2CO3═BaCO3↓+2NaCl;另外过量的 氢氧化钠和碳酸钠用盐酸来调节pH,也生成氯化钠,所以一共6个.
(7)测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH,这是检验溶液pH的正确方法.
故答案为:(1)H2O(或水); (2)会引入新的杂质氯化钡(或加入的氯化钡无法除去);
(3)铁架台;(4)BaSO4、BaCO3和CaCO3;(5)过量的氢氧化钠和碳酸钠;(6)6;
(7)玻璃棒蘸取(或用胶头滴管取)少许溶液B(或待测液)点(或滴)在pH试纸上,把试纸显示的颜色与标准比色卡比较,即可读出溶液的pH.
点评 本题考查了物质的除杂的有关问题,难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 南海是我国的固有领海,南海蕴藏着丰富的海洋资源.
南海是我国的固有领海,南海蕴藏着丰富的海洋资源.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 图甲为X、Y、Z三种固体物质的溶解度曲线,根据曲线可知30oC时X的溶解度为20g.在40oC时,小明同学欲配制100克28%的Y物质的溶液,他能(填“能”或“不能”)达到目的.
图甲为X、Y、Z三种固体物质的溶解度曲线,根据曲线可知30oC时X的溶解度为20g.在40oC时,小明同学欲配制100克28%的Y物质的溶液,他能(填“能”或“不能”)达到目的.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
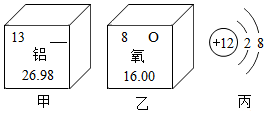 如图所示为某些元素和原子结构的部分信息.
如图所示为某些元素和原子结构的部分信息.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子数比为1:1的H2和Cl2 | B. | 分子数比为1:1的CO和O2 | ||
| C. | 质量比为1:5的CH4和O2 | D. | 质量比为1:3的C和O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com