
【题目】化学是研究物质的组成与结构、性质与变化、制法与用途的科学。以氢氧化钙为例,回答下列问题。
从组成与结构角度
(1)氢氧化钙是由_____元素组成的,是由_____(填微粒符号)构成的。
从性质与变化角度
(2)取 25mL 氢氧化钙饱和溶液于烧杯中,加热后溶液变浑浊,测得此时溶液的 pH>7。对产生此现象的原因作出猜想。
猜想一 氢氧化钙的溶解度随温度升高而减小猜想二 氢氧化钙与空气中的二氧化碳反应针对以上猜想,设计如下实验方案进行验证
方案一 将装有浊液的烧杯用冷水冷却,恢复至原温度,若观察到_____,则猜想一成立。
方案二 取适量浊液,过滤,往滤渣中加入稀盐酸,若观察到有气泡产生,则猜想二成立, 该反应的化学方程式为_____。
方案三 取适量浊液,过滤,往滤液中加入碳酸钠溶液,若观察到有白色沉淀生成,则猜想二成立。
上述方案三不正确,理由是_____。
(3)氢氧化钙饱和溶液加热后变浑浊的原因,除上述两个猜想外,请从其他角度再提出一个猜想_____。
从制法与用途角度
(4)生石灰与水反应能得到氢氧化钙,反应的化学方程式_____。
(5)物质的性质决定物质的用途。氢氧化钙能与酸反应,请写出一个体现该性质的氢氧化钙的用途_____。
(6)以石灰浆为原料制备氯酸钾,生产流程如下图
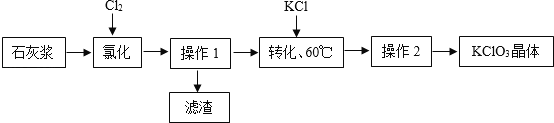
①“氯化”反应为 6Ca(OH)2+6Cl2=Ca(ClO3)2+5X+6H2O.则 X 的化学式为_____。
②为提高Cl2转化率,可行措施有_____(填序号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加入催化剂
【答案】钙 氢 氧 Ca2+ OH- 浑浊又重新变澄清 ![]() 碳酸钠与氢氧化钙反应产生白色沉淀,只能证明溶液中存在氢氧化钙 升温后水被蒸发,溶剂减少导致氢氧化钙析出
碳酸钠与氢氧化钙反应产生白色沉淀,只能证明溶液中存在氢氧化钙 升温后水被蒸发,溶剂减少导致氢氧化钙析出 ![]() 改良酸性土壤 CaCl2 AB
改良酸性土壤 CaCl2 AB
【解析】
(1)由氢氧化钙的化学式可知,氢氧化钙是由钙、氧、氢三种元素组成的,故填钙、 氢、氧;
氢氧化钙是由钙离子与氢氧根离子构成的一种碱,其离子符号依次是Ca2+、OH-,故填Ca2+、OH-。
(2)如氢氧化钙的溶解度随温度升高而减小,即温度降低,氢氧化钙的溶解度增大,则将装有浊液的烧杯用冷水冷却,恢复至原温度,氢氧化钙的溶解度增大,未溶解的氢氧化钙继续溶解,观察到现象是溶液由浑浊重新变澄清,故填浑浊重新变澄清;
往滤渣中加入稀盐酸,观察到有气泡产生,其中的反应是变质的氢氧化钙生成的碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
往滤液中加入碳酸钠溶液,有白色沉淀生成原因是碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,能够证明溶液中存在氢氧化钙,而不能说明氢氧化钙与空气中的二氧化碳发生了反应,故填碳酸钠与氢氧化钙反应产生白色沉淀,只能证明溶液中存在氢氧化钙。
(3)给饱和氢氧化钙溶液加热时,可能有部分水分蒸发,使得饱和溶液中的溶剂减少,溶液中的部分氢氧化钙结晶析出使溶液变浑浊,故填升温后水被蒸发,溶剂减少导致氢氧化钙析出。
(4)生石灰即氧化钙,氧化钙与水反应生成氢氧化钙,故反应的化学方程式写为:CaO+H2O=Ca(OH)2。
(5)氢氧化钙能与酸反应生成盐和水,是中和反应,可以利用该原理使用氢氧化钙来改良酸性土壤,故填改良酸性土壤。
(6)①由化学方程式可知,反应前出现了6个钙原子、12个氧原子、12个氢原子和12个氯原子,反应后出现了1个钙原子、2个氯原子、12个氧原子和12和氢原子,根据质量守恒定律,尚缺的5个钙原子和10个氯原子存在于5X中,则1个X中含有1个钙原子和2个氯原子,则X的化学式为CaCl2,故填CaCl2;
②A 适当减缓通入Cl2速率可以延长反应物的接触时间,能够使物质充分反应,提高反应物的转化率,选项正确;
B 充分搅拌浆料可以增大反应物之间的接触面积,提高反应物的转化率,选项正确;
C 催化剂只能加快反应的速率,并不改变反应物与生成物的质量比,所以加入催化剂并不能提高反应物的转化率,选项错误,故填AB。


科目:初中化学 来源: 题型:
【题目】除去下列物质中混有的杂质,所用试剂和操作方法不正确的
选项 | 物质 | 所含杂质 | 除杂质选用的试剂或方法 |
A | NaCl溶液 | NaOH | 加入适量的稀盐酸 |
B | Cu | Fe | 加入足量的稀盐酸并过滤 |
C | CO2 | CO | 在氧气中点燃 |
D |
| CaCl2固体 | 加入足量的水溶解并过滤、洗涤、干燥 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳的耗用量称为“碳足迹”。一般情况下,排放的二氧化碳较多,碳足迹就越大.以下做饭可以减小“碳足迹”的是( )

A. 大量使用煤、石油等燃料 B. 减少一次性筷子的使用
C. 将生活垃圾进行焚烧处理 D. 以私家车出行代替公共交通工具
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年版第五套人民币 5角硬币的材质已由“钢芯镀铜合金”改为“钢芯镀镍”,其表面色泽也因此由________ 色变为银白色。化学兴趣小组决定,探究制造 5角硬币的三种主要金属(铁、铜、镍)活动性顺序。
(查阅资料)
(1)硫酸镍溶液显绿色,Ni的化合价通常为+2价。
(2)镍能与稀硫酸反应,生成硫酸镍和氢气。
(提出猜想)猜想①:_________;猜想②:Fe>Ni>Cu。
(实验探究)
(1)甲组同学将一块表面洁净的镍片放入稀硫酸中,观察到的实验现象是_________,有关反应的化学方程式是_________。
(2)乙组同学将一块表面洁净的镍片浸入硫酸亚铁溶液中,一会儿取出,发现镍片表面无明显变化,说明猜想_________(填“①”或“②”)成立。
(3)丙组同学用铜片、硫酸镍溶液和_________进行实验,也得出了三种金属的活动性顺序。
(拓展延伸)
(1)某电镀公司的检修员利用工作之便,将镍网放入含有金盐的电镀液中偷偷“吸取”黄金,该盗窃手法利用了_________(填反应的基本类型)原理。该员工窃取贵重物品的行为,必将受到法律的制裁。
(2)金属活动性实际上是金属在水溶液中失去电子的能力大小。下列事实可以判断M、N两种金属活动性顺序的是_________(填序号)。
①M能和盐酸反应而N不能
②M、N分别放入盐酸中比较反应剧烈程度
③常温下M能与氧气反应而N不能
④M能从N的盐溶液中置换出N
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组在做“镁与稀盐酸反应”的实验时,发现一个意外现象,试管底部有灰白色沉淀生成。
[提出问题]出现灰白色沉淀是否为偶然现象?
[设计实验]实验1:向4份相同体积与浓度的稀盐酸中分别加入一定长度的镁带。
试管 | A | B | C | D |
镁带长度 | 1 cm | 2cm | 3 cm | 4cm |
实验现象 | 快速反应产生大量气泡,试管发热。最终镁带溶解 | 快速反应产生大量气泡,试管发热,镁带溶解,出现少量白色浑浊 | 快速反应产生大量气泡,试管发热,镁带溶解,出现灰白色沉淀 | 快速反应产生大量气泡,试管发热,镁带溶解,溶液变浑浊,久置得大量灰白色沉淀 |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
据表分析,______是实验出现“异常”的主要因素写出产生气泡反应的化学方程式____,实验前用砂纸打磨镁条的原因是______。
实验2:将少量灰白色沉淀用蒸溜水清洗并室温晾干。然后取样,按图加热固体,用湿润的蓝色石蕊试纸检验气体产物试纸变红;若另取一端用硝酸银溶液浸润的玻璃棒悬于试管口,出现白色浑浊,则灰白色沉淀中一定含有______元素。
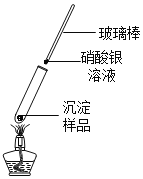
用pH计监测反应过程中溶液pH变化并读数。实验结果如下:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 | … | 放置过夜 |
溶液pH | 2.0 | 5.8 | 7.4 | 8.0 | 8.6 | 9.0 | 9.3 | 9.6 | 9.8 | 10.0 | 10.0 | … | 10.2 |
实验现象 | 一 | 大量气泡,无沉淀生成 | 镁带慢慢溶解,气泡量减少 ,溶液变浑浊,烧杯内灰白色沉淀逐渐增加 | ||||||||||
气泡减慢的原因是______,充分反应后溶液的pH____(填“>”、“<”或“=”)7。
[实验拓展]镁与稀盐酸反应时.试管中还出现白雾。哪种因素会促进反应过程中出现白雾?请设计实验进行验证。
影响因素:____________。
实验验证:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中A-J是初中化学常见的化合物。A和B物质类别相同,只有C、F、G、H、I由两种元素组成,B、C中含有一种相同的元素,C可用作干燥剂,J是焙制糕点所用的发酵粉的主要成分之一,E和J分别与足量I反应的生成物相同。图中“—”表示两的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
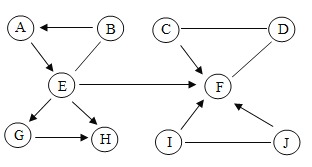
(1)写出化学式:J______,B_______。
(2)写出E→F反应的化学方程式_______。
(3)写出C与D反应的化学方程式_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,取相同质量的a、b、c、三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图l所示。图2为a、b、c三种物质的溶解度曲线。请仔细阅读图l和图2回答下列问题:
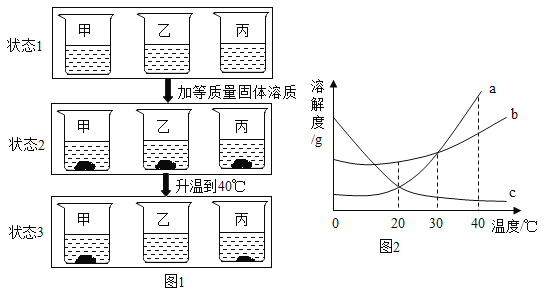
(1)三种物质的溶解度关系为b>a>c时的温度为t,则t的取值范围是___________。
(2)40℃时,烧杯_______里的溶液中溶剂最少。
(3) 各种状态下,各烧杯里的溶液中溶质质量分数的比较一定正确的是_________。
a.甲(状态2)>甲(状态1) b.乙(状态1)>甲(状态3)
c.甲(状态1)=乙(状态2) d.乙(状态3)>丙(状态3)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据图一、图二、图三,回答下列问题:

(1)由图二推测硝酸钾是图一中的_____物质。
(2)t2°C时,从1981.7 g甲物质的饱和溶液中蒸发10 g水,再降温到t2 °C ,可析出甲物质的质量为__。
(3)将t2°C时甲和乙两种物质的饱和溶液降温至t1°C时,所得溶液的溶质质量分数的大小关系是甲__乙(填“>”“<”或“=”)。
(4)图二“某一步操作”可按 如图三所示,将水滴入到盛有足量物质X的小试管中得以实现,则物质X可能是____(选填序号)
①生石灰 ②浓硫酸 ③硝酸铵 ④氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com