(2004?宿迁)一定质量的溶质质量分数为10%的A溶液和一定质量的溶质质量分数为20%的
NaOH溶液恰好完全反应,生成红褐色沉淀B,化学方程式为:A+3NaOH═B↓+3NaCl(已配平).
(1)A物质中阳离子和阴离子的个数比为______;
(2)A和B的相对分子质量之差为______;
(3)滤出沉淀B,向B中加入100g溶质质量分数为10.95%的盐酸,沉淀恰好完全溶解,试计算滤出沉淀B后所得滤液的质量.______.
【答案】
分析:(1)由方程式可知A物质中3个氯离子,再推出阳离子和阴离子的个数比;
(2)A和B的相对分子质量之差就是3NaOH和3NaCl的相对分子质量之差;
(3)题中已知盐酸溶质质量推出沉淀Fe(OH)
3的质量,进一步计算出A和NaOH的质量.便可计算所得溶液质量.
解答:解:(1)根据质量守恒定律可知反应前后各原子的种类和数目都不变,由于生成物中含有3个氯离子,所以反应物A中也需要有3个氯离子,所以A物质中阳离子和阴离子的个数比为1:3;
(2)由于参加反应的各物质质量总和等于反应后生成的各物质质量总和,所以A和B的相对分子质量之差就是3NaOH和3NaCl的相对分子质量之差即120 与175.5的差等于55.5;
(3)解:设沉淀B的质量为X
Fe(OH)
3+3HCl═FeCl
3+3H
2O
107 1O9.5
X 100 g×10.95%
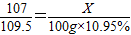
X=10.7 g
再设A溶液质量为y,NaOH溶液质量为Z
FeCl
3+3NaOH═Fe(OH)
3↓+3NaCl.
162.5 120 107
10%?Y 20%?Z 10.7 g
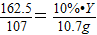
解得y=1 62.5 g Z=60 g
所以所得滤液质量为 162.5 g+60 g-10.7 g=211.8 g
答:滤出沉淀B后所得滤液质量为211.8 g.
故答案为:
(1)1:3;
(2)55.5;
(3)211.8 g
点评:通过回答本题知道了根据化学方程式来计算质量守恒定律方面知识的方法,计算反应后所得溶液质量的计算方法.

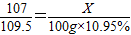
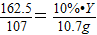 解得y=1 62.5 g Z=60 g
解得y=1 62.5 g Z=60 g

