
分析 充分反应后溶液的质量为20g+80g=100g,根据质量分数可求出氯化钠的质量;
根据氯化钠的质量求出氯化氢的质量,进而求质量分数
解答 解:(1)充分反应后溶液的质量为20g+80g=100g,则生成氯化钠的质量是:100g×5.85%=5.85g;故填:5.85;
(2)设80克的稀盐酸中氯化氢的质量为x
NaOH+HCl═NaCl+H2O
36.5 58.5
x 5.85g
$\frac{36.8}{58.5}=\frac{x}{5.85g}$
x=3.65g
所用稀盐酸的溶质质量分数:$\frac{3.65g}{80g}×100%$≈4.6%
答:所用稀盐酸的溶质质量分数为4.6%.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:解答题
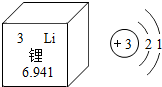 有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.
有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电视机着火时用水浇灭 | |
| B. | 进入久未开启的菜窖用手电筒照明 | |
| C. | 用钢丝刷擦洗铝锅上的污垢 | |
| D. | 厨房天然气泄漏,立即关闭阀门并轻轻开窗通风 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 生活离不开水,水既普通又宝贵.
生活离不开水,水既普通又宝贵.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
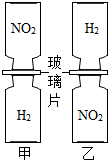 把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )
把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )| A. | 分子总是不断运动的 | |
| B. | 甲乙现象的差异与气体的密度有关 | |
| C. | 常温常压下,NO2的密度大于H2的密度 | |
| D. | 分子本身都是有大小的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:
如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
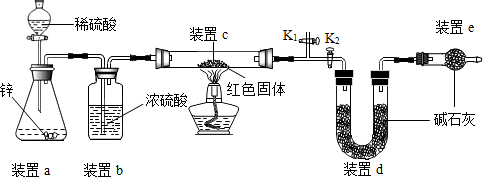
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com