解:(1)我们可用硫酸铜溶液作催化剂,分解双氧水制取氧气,反应的化学反应式是:2H
2O
2
2H
2O+O
2↑;
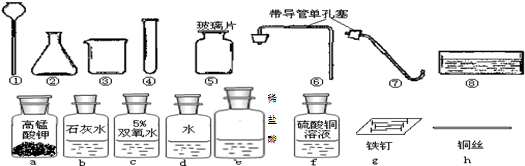
(2)反应物是双氧水和硫酸铜溶液,反应条件是常温,我们可以选择的仪器是②⑤⑥;
(3)根据碳酸盐的性质,碳酸盐可以与酸反应产生使石灰水变浑浊的气体,所以用到的药品be;
(4)在做酸碱中和反应时可在碱液中滴加酚酞用来判断溶液是否完全反应;
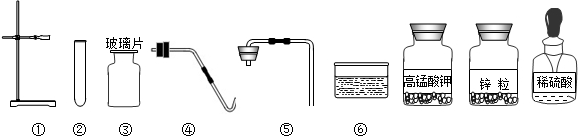
(5)证明铜在氢后,可用铜与稀盐酸反应,证明铁的活动性比铜强,可以让铁与铜的盐溶液发生反应,我们可以用铁与硫酸铜溶液反应;
故答案为:(1)2H
2O
2
2H
2O+O
2↑;
(2)②⑤⑥;
(3)b e;
(4)酚酞;
(5)证明铜在金属活动顺序表中排在氢后边.(或证明铁的活动性比铜强).
分析:(1)可以硫酸铜溶液作催化剂,分解双氧水制取氧气,并可根据反应物和反应条件写出化学反应式;
(2)根据反应物的状态是液体和液体,并且不需加热,选择实验装置;
(3)若要探究牙膏中是否含有碳酸钙,可用稀盐酸和碳酸钙反应生成能使石灰水变浑浊的气体二氧化碳的性质来检验;
(4)在做酸碱中和反应时可在碱液中滴加酚酞用来判断溶液是否完全反应;
(5)根据:排在氢前的金属可与盐酸反应生成氢气,而氢后的金属则不能,设计实验证明金属是在氢前、还是在氢后;活动性较强的金属一般可以将位于其后的金属从它们的盐溶液中置换出来.
点评:本题考查的是对化学反应原理、物质的性质和实验设计,综合考查了学生对基础知识的理解和应用.

 .
. 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;
2H2O+O2↑;

 名校课堂系列答案
名校课堂系列答案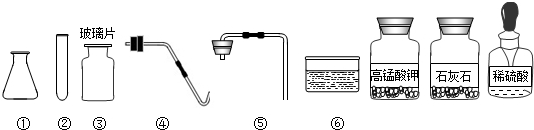


 .
.