14.化学是一门以实验为基础的学科,通过一年的学习,相信你的实验能力一定有了很大提高,请你一同参与回答以下问题.
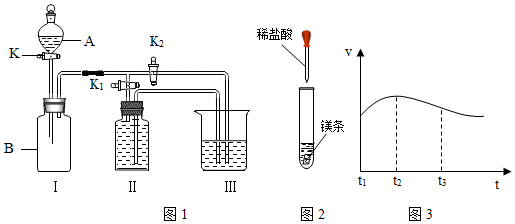
(一)某实验小组设计了图1所示的实验装置.
(1)写出仪器A的名称分液漏斗
(2)甲同学认为打开K
1、关闭K
2时,利用I、Ⅱ装置,可以制取并收集氧气,该化学反应方程式为:
2H
2O
2$\frac{\underline{\;MnO_2\;}}{\;}$2H
2O+O
2↑.
(3)乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量.关闭K、K
1、K
2,用凸透镜引燃B中的白磷,待冷却后打开K
2,整个实验过程中能观察到的现象是:①白磷燃烧,产生大量白烟,放出热量;②待冷却后打开K
2,Ⅲ中的水倒流入Ⅰ中约占瓶内气体体积的$\frac{1}{5}$.
(4)丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳能与氢氧化钠溶液发生反应.他在广口瓶B中预先收集满二氧化碳气体,在仪器A中盛放氢氧化钠浓溶液,烧杯中盛放稀盐酸,K
1关闭、K
2打开,然后打开K将氢氧化钠浓溶液滴入广口瓶中,关闭K,依据)Ⅲ中稀盐酸倒流入Ⅰ中,并有气泡产生现象,可以证明二氧化碳能与氢氧化钠溶液发生化学反应.
(二)甲、乙两同学对有关镁与盐酸的反应进行了系列研究(如图2)
探究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:′
(1)实验时需将镁条进行打磨,其目的是除去金属表面的氧化物.
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,
化学方程式为Mg+2HCl═MgCl
2+H
2↑.
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图3所示,你认为在t
1~t
2时间内反应速率逐渐加快的主要原因是:镁与盐酸反应放热,温度越高,反应速率越快.
探究二:.反应后所得溶液的酸碱性探究
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈酸性,(选填“酸”“碱”或“中”).
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红.
【查阅资料】氢氧化镁微溶于热水,且溶解度随温度升高而增大.
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;
猜想Ⅱ:氯化镁溶液pH小于7.
乙同学:猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;
猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色.
【实验与思考】
(1)为验证猜想,甲、乙两同学均需测定氯化镁溶液的酸碱性,实验表明该溶液显弱酸性.
(2)乙同学为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧,请根据以上现象写出镁与热水反应的化学方程式Mg+2H
2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)
2+H
2↑;
(3)乙同学在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失,于是他猜想可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉了,但甲同学猜想可能是水温逐渐降低,导致Mg(OH)
2的溶解度减小而析出沉淀,请你设计一个简单的实验方案验证甲或乙的猜想是否成立 (写出相应的操作、现象和结论):将褪色后的溶液加热,若溶液又变红,则是由于温度降低导致Mg(OH)
2的溶解度减小.
【结论】
镁与稀盐酸反应,若镁反应完全后所得溶液显酸性,若镁过量时所得溶液显碱性.

 星级口算天天练系列答案
星级口算天天练系列答案