
| A. | NaOH、KCl、MgCl2 | B. | KNO3、NaCl、H2SO4 | ||
| C. | FeCl3、NaCl、NaNO3 | D. | Na2SO4、BaCl2、HCl |
分析 本题考查利用复分解反应的条件来判断常见物质间的反应及溶解性规律,若物质之间相互交换成分,能结合成沉淀的则不能得到透明的溶液;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:A、氢氧化钠能与氯化镁反应生成氢氧化镁沉淀,不透明,故错误;
B、三者之间不反应,且都是无色透明溶液,故此选项正确;
C、三者之间不反应,但氯化铁溶于水呈黄色,故此选项错误;
D、硫酸钠与氯化钡反应生成硫酸钡是沉淀,不透明,故此选项错误;
故选B.
点评 本题主要考查了离子的共存和溶液的带色问题,难度不是很大,对于能否得到无色透明的溶液,要注意彼此之间不能生成沉淀,还要注意特定离子的颜色,因此熟练掌握常见物质的溶解性规律及特殊离子的颜色是解题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
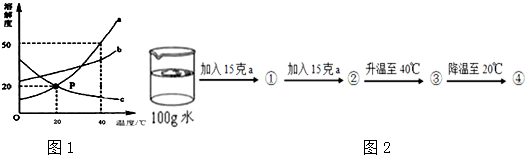
 研究性学习小组选择“过氧化氢(H202)生成氧气(02)的快慢与什么因素有关”的课题进行研究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢(H202)生成氧气(02)的快慢与什么因素有关”的课题进行研究,以下是他们探究的主要过程:| 实验编号 | 1 | 2 |
| 反应物 | 6% H202 | 6% H202 |
| 催化剂 | lg红砖粉 | lg Mn02 |
| 时间 | 152s | 35s |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
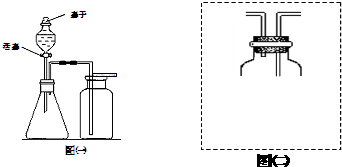
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 质量守恒定律为定量揭示化学变化的规律,提供了理论依据 | |
| B. | 通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量 | |
| C. | 随着科技的发展,精密仪器为我们定量研究化学变化创造了条件 | |
| D. | 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人胃酸(主要成分是盐酸)过多,会引起很胃病.如图为某抗酸药包装标签上的部分文字,请回答下列问题.
人胃酸(主要成分是盐酸)过多,会引起很胃病.如图为某抗酸药包装标签上的部分文字,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com