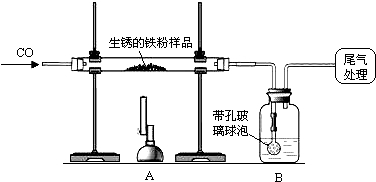
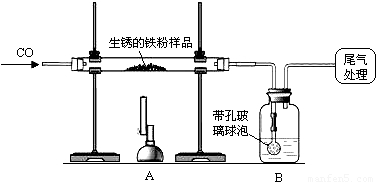
解:(1)一氧化碳还原氧化铁的化学反应式是:3CO+Fe
2O
3 
2Fe+3CO
2.
故答案为:3CO+Fe
2O
3
2Fe+3CO
2;
(2)能很好的吸收二氧化碳的物质是氢氧化钠浓溶液,所以欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数.应选用的最佳试剂是氢氧化钠浓溶液.它与二氧化碳的化学反应式是:CO
2+2NaOH=Na
2CO
3+H
2O.
故答案为:氢氧化钠、CO
2+2NaOH=Na
2CO
3+H
2O;
(3)燃烧掉多余的一氧化碳是消除污染的较好方法.
故答案为:在末端加上一燃着的酒精灯把剩余的一氧化碳燃烧掉.
(4)原有样品为氧化铁(10g),反应后为剩余固体为(9.04g),减少的质量为0.96g,实质为氧元素的质量,运用差量法解题
设氧化铁的质量为X
3CO+Fe
2O
3 
2Fe+3CO
2 △m
160 112 48
X 0.96g
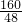
=
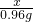
,X=3.2g
氧化铁的质量分数为:
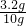
×100%=32%
故答案为:32%
分析:(1)根据一氧化碳还原氧化铁写出化学反应式;
(2)氢氧化钠浓溶液可以很好的吸收二氧化碳气体,我们可以通过称量化学反应前后的B装置质量,和化学反应式计算样品中氧化铁的质量分数;
(3)为减少污染最好是将一氧化碳点燃并消耗掉.
(4)根据装置B增重,计算出氧化铁的质量,然后根据铁粉样品的总质量计算氧化铁的质量分数.
点评:本题是一氧化碳还原氧化铁实验,(4)小题较难,学生容易出错,容易忽略氢氧化钙微容这个隐含条件.一般检验二氧化碳选用澄清石灰水,而吸收二氧化碳则选用氢氧化钠溶液,若本题将澄清石灰水换做氢氧化钠,则也可以根据溶液增重计算样品中氧化铁的质量分数.

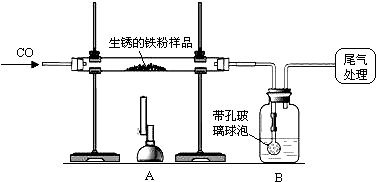
 2Fe+3CO2.
2Fe+3CO2. 2Fe+3CO2;
2Fe+3CO2; 2Fe+3CO2 △m
2Fe+3CO2 △m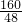 =
=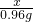 ,X=3.2g
,X=3.2g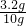 ×100%=32%
×100%=32%