
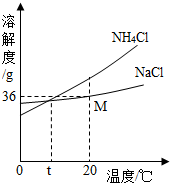
 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
| ||
| ||
| 14 |
| 14+1×4+35.5 |


科目:初中化学 来源: 题型:阅读理解
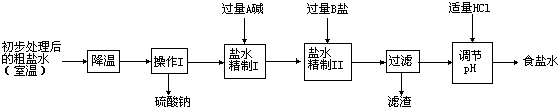
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
 向纯碱的水溶液中滴入酚酞试液,试液变
向纯碱的水溶液中滴入酚酞试液,试液变查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 纯碱属于
纯碱属于
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com