
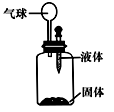
| A.①③ | B.②③ | C.②④ | D.③④ |
科目:初中化学 来源:不详 题型:单选题
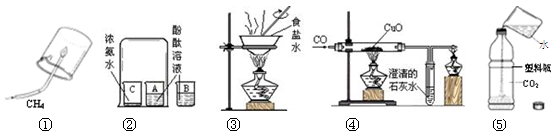
|
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.FeCl3、CuSO4、KCl | B.BaCl2、Na2SO4、NaOH |
| C.CaCl2、K2CO3、AgNO3 | D.K2SO4、KNO3、NH4NO3 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 选项 | 实验名称 | 实验方案 |
| A | 检验某固体物质中是否含有碳酸盐 | 取少量样品于试管中,滴加足量的稀盐酸,看到有气泡产生,则该固体物质中含有碳酸盐 |
| B | 检验集气瓶中是否集满二氧化碳 | 将燃着的木条伸入集气瓶中燃着的木条熄灭集气瓶中已集满二氧化碳 |
| C | 除去二氧化碳中混有的一氧化碳 | 将混合气体通过足量的澄清石灰水,澄清石灰水变浑浊,则得到一氧化碳 |
| D | 鉴别碳酸钠和碳酸钙固体 | 分别取少量样品于试管中,依次滴加足量水,振荡试管,固体溶解的是碳酸钠,无明显变化的是碳酸钙。 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
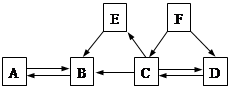
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.①④⑤ | B.①②⑤ | C.①②③ | D.③④⑤ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.样品中一定没有MgCO3 |
| B.NaCl不与盐酸反应,说明样品中一定没有NaCl |
| C.所加稀盐酸中溶质的质量分数为7.3% |
| D.Na2CO3和MgCO3都能和稀盐酸反应生成气体,说明样品中一定有Na2CO3和MgCO3 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
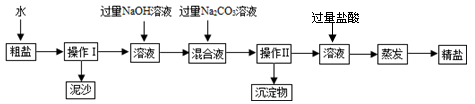
| A.滤纸破损,滤液浑浊就蒸发 |
| B.蒸发时未用玻璃棒,有一些液体溅出 |
| C.提纯后所得精盐尚未完全干燥 |
| D.溶解时水的量太少,使食盐未完全溶解 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 | | 滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 | 产生无色 无味气体。 | 滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 产生白色沉淀。 | 滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀。 | 反应的化学方程式: 。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com