
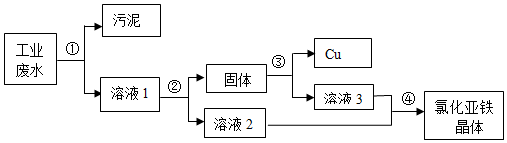
分析 (1)此过程是对铜的分离,为了不引入新的杂质此处应放金属铁,由于是溶液与铜的分离故可采用过滤的方法完成;
(2)由于固体中含有铜与过量的铁,所以要得到纯净的铜应该消耗掉金属铁,加稀硫酸可使铁被消耗;
(3)不加稀硫酸时铁粉无法除掉,此处过量的铁粉是必须要加的,因为只有②中加入过量的铁粉才能使铜能被彻底置换出来;
(4)从溶液中得到硫酸亚铁可采用蒸发溶剂的方法进行,溶液2、3中都含有硫酸亚铁为综合利用应该使其混合.
解答 解:(1)此过程是置换出铜的过程,为了在不引入新的杂质的前提下用金属铁置换较为合适,由于分离的方法是溶液与铜的分离故可采用过滤的方法完成,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(2)为把铜能彻底置换出来加入铁的质量应该是过量的,因此固体中含有铜与过量的铁,所以要得到纯净的铜应该消耗掉金属铁,加稀硫酸可使铁被消耗又不引入新的杂质,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(3)由于固体中既有铜又有铁,不加稀硫酸时铁粉无法除掉,此处过量的铁粉是一定存在的,因为只有②中加入过量的铁粉才能使铜能被彻底置换出来.所以为了将铁和铜分离,要进行第3步;
(4)从溶液中得到硫酸亚铁溶质可采用蒸发溶剂的方法进行,因为溶液2、3中都含有硫酸亚铁为综合利用减小浪费应该使其混合.
故答案为:(1)铁,过滤,Fe+CuSO4=FeSO4+Cu;
(2)稀硫酸,Fe+H2SO4=FeSO4+H2↑;
(3)不合理,因为要使Cu2+完全置换出来,必须加入过量的铁;
(4)蒸发,两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用.
点评 本题是一道金属回收题,解题的关键是要明确回收的原理,结合题目内的框题进行分析探讨,是一道分离混合物的综合题.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 只有分解反应才需要催化剂 | |
| B. | 催化剂在化学反应前后本身的质量和化学性质不变 | |
| C. | 某些化学反应可以有多种催化剂 | |
| D. | 使用催化剂可以增加生成物的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洒在桌面上的酒精燃烧起来,立即用湿抹布扑盖 | |
| B. | 室内燃气泄漏时,迅速开灯检查 | |
| C. | 用湿毛巾捂住口鼻,蹲下沿墙角逃离着火区域 | |
| D. | 图书、档案起火时,用二氧化碳灭火器扑灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeSO4溶液、Zn、Ag | B. | ZnSO4溶液、稀盐酸溶液、Fe、Ag | ||
| C. | ZnCl2溶液、Ag NO3溶液、Fe | D. | ZnSO4溶液、FeSO4溶液、Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com