
| A. | 6.42 | B. | 7.62 | C. | 9.22 | D. | 无法计算 |
分析 根据反应方程式判断CO2中的O原子来源于CO和金属氧化物,计算出氧化物中氧元素的质量,金属氧化物的质量等于金属的质量加氧化物中氧元素的质量.
解答 解:设生成的二氧化碳的质量为x
CO2+Ca(OH)2═CaCO3↓+H20
44 100
x 10g
$\frac{44}{100}=\frac{x}{10g}$
x=4.4g,
发生的有关反应为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,ZnO+CO$\frac{\underline{\;高温\;}}{\;}$Zn+CO2,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,
二氧化碳中碳元素的质量等于一氧化碳中碳元素的质量,故一氧化碳中碳元素质量为:4.4g×$\frac{12}{44}$×100%=1.2g,一氧化碳中氧元素质量为1.2g×$\frac{16}{12}$=1.6g,二氧化碳中氧元素的质量为4.4g-1.2g=3.2g,从反应方程式可以看出,CO2中的O原子来源于CO和金属氧化物,故金属氧化物中氧元素的质量为3.2g-1.6g=1.6g,所以金属氧化物的质量为4.82g+1.6g=6.42g,即a=6.42.
故选:A.
点评 本题考查混合物的质量计算,题目难度较大,注意从元素质量守恒的角度分析.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
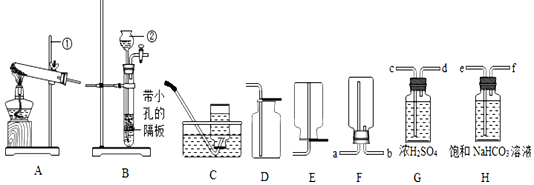
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
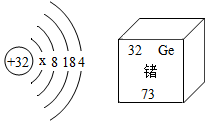
| A. | 在元素周期表中锗元素与硫元素位于同一族 | |
| B. | x=2 | |
| C. | 锗原子的核外电子数为32 | |
| D. | 锗原子夺的中子数为41 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
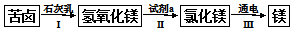

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
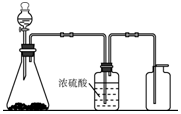 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com