
 100克某浓度的硫酸恰好与13克的锌完全起反应,请计算:
100克某浓度的硫酸恰好与13克的锌完全起反应,请计算:分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(2)锌和稀硫酸反应生成硫酸锌和氢气,根据锌的质量可以计算生成氢气的质量;
(3)根据锌的质量可以计算生成硫酸锌的质量,进一步可以计算硫酸锌溶液中硫酸锌的质量分数
解答 解:(1)H2SO4的相对分子质量为1×2+32+16×4=98.
(2)设生成氢气的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 161 2
13g y x
$\frac{65}{13g}$=$\frac{161}{y}$=$\frac{2}{x}$,
x=0.4g,y=32.2g,
答:生成氢气的质量是0.4g.
(3)反应后所得溶液中溶质的质量分数为:$\frac{32.2g}{100g+13g-0.4g}$×100%=28.6%,
答:反应后所得溶液中溶质的质量分数为28.6%
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可用Ba(OH)2溶液鉴别(NH4)2CO3、(NH4)2SO4、NH4NO3三种氮肥 | |
| B. | MgCl2溶液、NaOH溶液、H2SO4溶液、CuSO4溶液,不另加任何试剂即可鉴别 | |
| C. | Na2CO3溶液、Ca(OH)2溶液、盐酸、BaCl2溶液,不另加任何试剂即可鉴别 | |
| D. | CuO粉末、炭粉、铁粉,三种黑色粉末用一种试剂无法鉴别 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 用途 | 性质 | |
| A | 活性炭 | 净化水 | 吸附性 |
| B | 汞 | 水银温度计 | 熔点低 |
| C | 稀有气体 | 霓虹灯 | 通电时发出各种颜色的光 |
| D | 氢氧化钙 | 治疗胃酸过多 | 碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验步骤 | 观察到的现象 | 获得结论 | 有关反应的化学方程式 |
| 取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | 固体完全溶解,溶液变蓝 | 黑色粉末均为氧化铜 | CuO+H2SO4=CuSO4+H2O |

| 反应前 | 反应后 |
| 玻璃管和内盛氧化铜粉末的总质量为62.0g | 玻璃管和内盛红色粉末的总质量为61.7g |
| 玻璃管的质量为60.0g | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
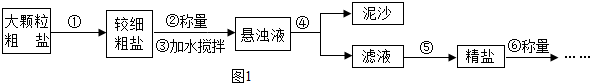
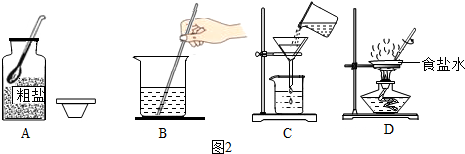

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com