
| A. | ②④③①⑤⑥⑦ | B. | ②④③①⑤⑦⑥ | C. | ②①③④⑤⑥⑦ | D. | ②①⑥⑦③④⑤ |
分析 根据加热氯酸钾或加热高锰酸钾分解制取氧气时,操作步骤和注意点分别是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→装(装入固体药品,注意用高锰酸钾时,在试管口放一团棉花)→定(用铁架台固定仪器装置)→点(用火柴点燃酒精灯,给试管加热;注意要用外焰,先预热,再固定在有药品的部位加热)→收(收集氧气)→移(把导管移出水面)→熄(熄灭酒精灯),进行解答.
解答 解:根据实验室用加热方法制取氧气的操作步骤:连、查、装、定、点、收、移、熄,可得题中正确的操作顺序是:②④③①⑤⑥⑦;
故选A.
点评 熟记制取氧气的实验步骤、装置示意图及其中仪器的名称、注意事项等等,方能顺利解题.


科目:初中化学 来源: 题型:选择题
| A. | 4.3×10-26kg | B. | 4.3 | C. | 52.0 | D. | 52.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
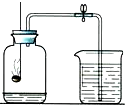 为了测定空气中氧气的含量,按如图进行实验:请通过实验现象和题中信息,按要求填空:
为了测定空气中氧气的含量,按如图进行实验:请通过实验现象和题中信息,按要求填空:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气的成分按质量分数计算,氮气约占78%,氧气约占21% | |
| B. | 稀有气体都没有颜色,没有气味,化学性质很不活泼 | |
| C. | 空气是一种十分重要的资源 | |
| D. | 工业上分离液态空气制氧气,没发生化学变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
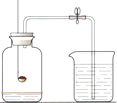 如图是测定空气中氧气含量的实验装置根据实验回答问题.
如图是测定空气中氧气含量的实验装置根据实验回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
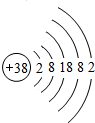 据《自然》杂志报道,科学家最近研制的一种以锶原子做钟摆的钟是世界上最精确的钟.锶元素(元素符号为Sr)原子结构示意图如图所示.
据《自然》杂志报道,科学家最近研制的一种以锶原子做钟摆的钟是世界上最精确的钟.锶元素(元素符号为Sr)原子结构示意图如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
时间(min) 浓度 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入W g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入W g Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com