
 小军见到一种“化学爆竹”(见图),只要用手拍打锡纸袋,掷在地上,锡纸袋随后会突然爆开并伴随响声.他认为,这是锡纸袋中的物质发生化学反应生成气体造成的,于是想探究锡纸袋中的物质成分.
小军见到一种“化学爆竹”(见图),只要用手拍打锡纸袋,掷在地上,锡纸袋随后会突然爆开并伴随响声.他认为,这是锡纸袋中的物质发生化学反应生成气体造成的,于是想探究锡纸袋中的物质成分.| 主要实验装置 | 主要操作步骤 | 主要实验现象 | 实验操作目的 |
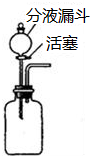 | 在瓶中加入少量白色固体,再加入适量水,振荡,静置 | 白色固体溶解 | 验证白色固体是否可溶 |
| ①在分液漏斗中加入稀盐酸塞上胶塞,打开活塞,放出适量溶液后,关闭活塞 ②将气体通入澄清石灰水 | ①有大量气泡产生 ②澄清石灰水变浑浊 | 验证生成气体的成分 | |
| 实验的初步结论:白色固体是可溶性碳酸盐,可能为碳酸钠或碳酸氢钠 | |||
| 温度 溶解度 盐 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.7g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
分析 [查阅资料]
①过氧化氢化学式为H2O2,不稳定易分解生成水和氧气;在二氧化锰催化下分解速度加快;
[猜想与验证]
(1)酸能使紫色石蕊变成红色,为便于观察颜色变化,可取石蕊滴入水中进行对比;
(2)碳酸盐遇酸可放出能使澄清石灰水变浑浊的气体二氧化碳,实验室通常使稀盐酸和澄清石灰水检验碳酸盐;该实验为检验白色固体为含有碳酸根或碳酸氢根的盐,因此,可采取上述方法进行;
碳酸钠和碳酸氢钠的溶解性存在很大差异,可使用这一特点,取一定量白色固体在一特定温度下溶解,由于碳酸钠的溶解度较大,因此如果所取固体完全溶解,则白色固体为碳酸钠;
[反思]
碳酸钠和碳酸氢钠在组成上很相似,但组成毕竟是不同的,那么,它们除了溶解性上的差异外,在化学性质上是否也有不同.
解答 解:[查阅资料]
①二氧化锰催化下过氧化氢分解生成水,同时放出氧气;
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
[猜想与验证]
(1)取相同量的水滴加此色石蕊液,石蕊仍为紫色,对比酸溶液使石蕊变红,使现象更明显;
故答案为:作空白实验,进行对比;
(2)为检验白色固体为含有碳酸根或碳酸氢根的盐,采取滴加稀盐酸并把产生气体通入澄清石灰水,石灰水变浑浊即可得到白色固体为含有碳酸根或碳酸氢根的盐的初步结论;
故答案为:①稀盐酸;②将气体通入澄清石灰水;澄清石灰水变浑浊;
为便于操作选取室温下进行白色固体的溶解;根据两物质在20℃时的溶解度:碳酸钠为21.5g、碳酸氢钠为9.6g,因此可取白色固体质量大于9.6g而小于21.5g之间的质量加入100g水中进行溶解,白色固体若全部溶解则为碳酸钠,白色固体若未能完全溶解则为碳酸氢钠;
故答案为:20℃时,在100g水中加入11g该白色固体,充分溶解后,若有白色固体剩余,为碳酸氢钠;否则为碳酸钠;
[反思]
两种物质都含有碳酸根,但碳酸氢钠中还含有氢,它们的化学性质是否相同可进一步进行探究;
故答案为:碳酸钠和碳酸氢钠化学性质上有哪些差异.
点评 利用物质溶解性的明显差异,取一定量物质进行溶解,根据溶解的情况也能区别物质.


 优学名师名题系列答案
优学名师名题系列答案科目:初中化学 来源: 题型:填空题
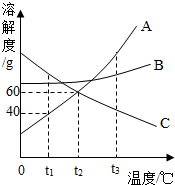 如图是 A、B、C三种物质的溶解度曲线.请回答:
如图是 A、B、C三种物质的溶解度曲线.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
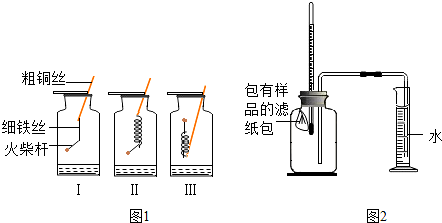
| 序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
| 1 | 1g铁粉、0.2g碳、10滴水 | 100 | 72 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
| 3 | / | / | / |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 10 | 10 | 20 |
| 所加稀硫酸的质量/g | 100 | 120 | 80 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com