

分析 (1)根据粗盐提纯的过程进行分析;
(2)过滤时要用到的玻璃仪器有:烧杯、漏斗、玻璃棒;玻璃棒的用途进行分析;
(3)根据常见的净化水的方法和原理,对比分析,判断净化程度最高的方法;
(4)根据除杂质的注意事项:加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质;
(5)首先正确写出锌和稀硫酸反应的化学方程式,以及中和反应;
(6)铜不能和硫酸亚铁反应,铝和硫酸亚铁反应生成硫酸铝和铁;
(7)①根据配制100g溶质质量分数为6%的氯化钠溶液的实际实验步骤来选择答案;
②根据溶质质量分数的计算公式进行分析解答即可.
解答 解:(1)图中①是蒸发池,故选:蒸发;
(2)过滤可以将液体中的不溶物和液体进行分离,过滤时要用到的玻璃仪器有:烧杯、漏斗、玻璃棒;过滤时玻璃棒的作用是引流;故答案为:漏斗;引流;
(3)通过蒸馏除去了水中所有的杂质,所得到的水为纯净物,净化程度最高;故选:C;
(4)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,所加试剂的顺序是加稍过量的Ba(OH)2溶液,除去MgSO4,再加稍过量的Na2CO3溶液,除去CaCl2,最后加适量的盐酸,中和前后过量的Ba(OH)2和Na2CO3;故选:B;
(5)锌和稀盐酸反应制取氢气的化学方程式:Zn+2HCl=ZnCl2+H2↑,该反应是放热反应,中和反应是酸碱发生反应,碳酸钠属于盐,纯碱和稀硫酸反应不是中和反应;故填:Zn+2HCl=ZnCl2+H2↑;放热;不是;
(6)利用硫酸亚铁溶液可以区分Fe、Cu、Al这三种金属的活动性,把铜丝伸入硫酸亚铁溶液中时,无明显现象,说明铜不如铁活泼;把铝丝伸入硫酸亚铁溶液中时,铝丝表面附着了一层黑色物质,说明铝比铁活泼,因此铝比铁活泼,铁比铜活泼,故选:B;
(7)①配制100g溶质质量分数为6%的氯化钠溶液,基本步骤是:计算、称量、量取、溶解、装瓶贴标签,故填:BACD;
②将已配好的100g质量分数为10%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加NaCl的质量为x,则有:
(100g+x)×20%=100g×10%+x
x=12.5g
故填:12.5g.
点评 本题考查的是海水晒盐的知识,完成此题,可以依据已有的知识进行.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:初中化学 来源: 题型:推断题
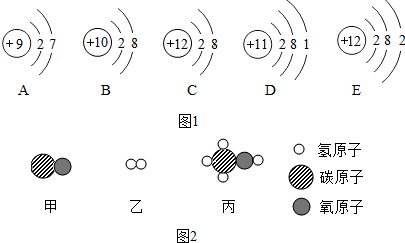
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO2 | HCl | 通过饱和NaHCO3溶液和浓硫酸 |
| B | NaCl溶液 | Na2SO4溶液 | 加入适量的硝酸钡溶液,过滤 |
| C | MnO2 | KCl | 加水充分溶解,过滤、蒸发结晶 |
| D | NaOH溶液 | Ca(OH)2溶液 | 加入适量碳酸钠溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
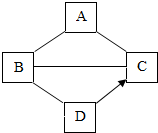 A、B、C、D为初中化学学过的四种不同类别的无机化合物,其中A为一种盐,但它的水溶液显碱性,D为生石灰,“→”表示相邻的物质之间可以转化(部分反应物、生成物、反应条件略去)“-”表示相连的物质之间在一定条件可以发生反应.请回答下列问题.
A、B、C、D为初中化学学过的四种不同类别的无机化合物,其中A为一种盐,但它的水溶液显碱性,D为生石灰,“→”表示相邻的物质之间可以转化(部分反应物、生成物、反应条件略去)“-”表示相连的物质之间在一定条件可以发生反应.请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
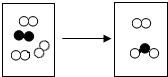 如图是密闭体系中某反应的微观示意图,“〇”和“●”分别表示不原同子.
如图是密闭体系中某反应的微观示意图,“〇”和“●”分别表示不原同子. B、
B、 C.
C.
 ”和“
”和“ ”分子个数比是2:1,反应所属的基本反应类型是化合反应.
”分子个数比是2:1,反应所属的基本反应类型是化合反应.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
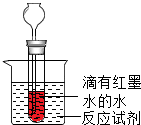 微量便于观察化学反应过程中放热、吸热的现象,某同学设计了如图所示装置(在烧杯内进行化学反应,反应溶液为无色).
微量便于观察化学反应过程中放热、吸热的现象,某同学设计了如图所示装置(在烧杯内进行化学反应,反应溶液为无色).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 氯化铁、氢氧化钠、稀盐酸 | B. | 硫酸钠、氯化钡、稀硝酸 | ||
| C. | 氢氧化钙、碳酸钠、稀盐酸 | D. | 硝酸钾、氯化钾、稀硝酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
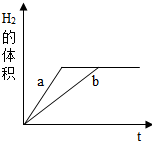 质量相等的铁和锌分别和质量相等,溶质质量分数也相等的稀盐酸反应,反应情况如图所示,则下列叙述中正确的是( )
质量相等的铁和锌分别和质量相等,溶质质量分数也相等的稀盐酸反应,反应情况如图所示,则下列叙述中正确的是( )| A. | 图线a、b分别表示铁、锌的反应情况 | B. | 盐酸均反应完,一定有铁剩余 | ||
| C. | 盐酸均反应完,一定有锌剩余 | D. | 锌、铁均反应完,盐酸有剩余 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com