
����Ŀ��ij��ѧ��ȤС�����������е�Ħ����(��̼��ơ������������)ѡȡ����ͼ��ʾװ��(ͼ�мг�������ȥ)ģ�ҵ������
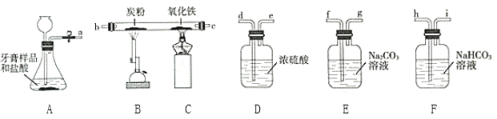
(1)��д��Aװ���в�������Ļ�ѧ����ʽ____________��
(2)��Ҫ��ȡ�����������CO2��������������ѡ��װ�õĵ��ܽӿڴ����ҵ���ȷ����˳��Ϊ____________________��
(3)��д��װ��C�������е�ʵ������_______________��
(4)����ʵ��ʱ��С���Ա���ָ���װ����һ�����ԵIJ��㣬Ӧ��θĽ�___________?
(5)A����ȡ��CO2�����ڡ������Ƽ������ؼ�һ���ķ�Ӧԭ��Ϊ��NH3+CO2+H2O+NaCl![]() NaHCO3��+X������˵������ȷ����__________��
NaHCO3��+X������˵������ȷ����__________��
A.�����Ƽ�Ĺ�������Ӧ���������ܽ�ȵIJ���
B.������X��ũҵ�Ͽ��������Ϸ�
C.NaHCO3��ҽ���Ͽ���������θ�����
(6)��C���еõ��������뵽����ͭ���������Ļ����Һ�У���ַ�Ӧ����ˣ��õ���������Һ��
��������һ���У�__________(�ѧʽ)��
����д���ù����п��ܷ����Ļ�ѧ����ʽ__________��
(7)ijͬѧ��������һ��������ԭ100g������ַ�Ӧ��ʣ����������Ϊ76g����100g�ó�����������������������______________(������һ����̼����Ӧ)��
���𰸡� CaCO3+2HCl=CaCl2+H2O+CO2�� a-h-i-d-e-b-c ����ɫ��ĩ��ڡ� ��װ��Cĩ�˷�һյȼ�ŵľƾ��ơ�(��������) B Ag Fe+Cu(NO3)2=Fe(NO3)2+Cu 80g
��������(1)̼��ƺ����ᷴӦ�����Ȼ��ơ�������̼��ˮ����Ӧ��ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2����(2)��Ҫ��ȡ�����������CO2������������Ӧ������̼�����Ƴ�������ӷ���������Ȼ������壬Ȼ����Ũ������������̼��̼�ڸ����·�Ӧ���ɻ�ԭ��һ����̼����ϴ��ƿ�У����嶼�dz��ܽ����̹ܳ�����ѡ��װ�õĵ��ܽӿڴ����ҵ���ȷ����˳��Ϊa-h-i-d-e-b-c��(3)�������Ǻ�ɫ���壬��һ����̼��Ӧ�������ۣ���ɫ���Ͷ�����̼��װ��C�������е�ʵ���������ɫ��ĩ�����(4)����װ��û��β������װ�ã��ᵼ����Ⱦ�������Ľ������ǣ���װ��Cĩ�˷�һյȼ�ŵľƾ��ƣ�(5) A.�����Ƽ�Ĺ�������Ӧ���˳�����̼�����Ƶ��ܽ�Ƚ�С�����Ȼ�淋��ܽ�Ƚϴ����Է�Ӧ��̼�����ƶ��Ծ������������Ȼ�臨��ܽ⣬��ȷ�� B.������XΪ�Ȼ�泥�����ֻ����Ӫ��Ԫ���еĵ�����ũҵ�Ͽ��������ʣ�����C.NaHCO3�����ᷴӦ�����Ȼ��ơ�������̼��ˮ����ҽ���Ͽ���������θ����࣬��ȷ����ѡB��(6) �ڽ����˳����У�������ǰ�ߵĽ����ܺ��ᷢ���û���Ӧ�����κ�������������λ��Խ��ǰ�������Ļ��Խǿ��λ�ÿ�ǰ�Ľ����ܽ�λ�����Ľ�������������Һ���û��������������뵽����ͭ���������Ļ����Һ�У�����������������Ӧ������������������ʣ�����������ͭ��Ӧ��������������ͭ����ַ�Ӧ����ˣ��õ���������Һ����������һ���У�������Ag���ڸù����������������ķ�Ӧһ���ܷ�������������ͭ�ķ�Ӧ���ܷ�����ȡ�������۵����������ܷ����Ļ�ѧ����ʽFe+Cu(NO3)2=Fe(NO3)2+Cu��(7)��������һ��������ԭ100g������ַ�Ӧ��ʣ����������Ϊ76g������Ӧǰ�����IJ�ֵΪ��100g��76g��
������ʯ�к��е�����������Ϊx��
3CO+Fe2O3![]() 2Fe+3CO2 ��m�����壩
2Fe+3CO2 ��m�����壩
160 112 48
x 100g-76g
![]()
x=80g
��100g�ó�����������������������Ϊ80g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��ת����������һ�����ŵ��о����⡣�ش������������:
(1)2016���ҹ�������Ա���Ƴ�һ�֡��ɺ���CO2���ĵ�أ��ŵ�ʱ�õ�ء�����CO2�������ʱ�õ�ء��ų�CO2�����ŵ�ʱ�������ƺ�CO2�����û���Ӧ����һ�ַǽ������ʺ�һ�ֳ������Σ�д���˷�Ӧ�Ļ�ѧ����ʽ_________��
(2)2018��5�£�ij��־�������ҹ���һ���о��ɹ�����һ���´��������¿�ʵ�ֶ�����̼��Чת��Ϊ�״�����ط�Ӧ��ͼ��ʾ���μӷ�Ӧ�ļ��ҵķ��Ӹ���֮��Ϊ_________��
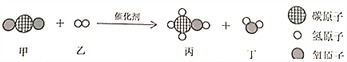
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ������ݻش��������⡣
�¶� �ܽ�� ���� | 0 | 20 | 40 | 60 | 80 |
|
|
|
| 110 | 169 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
![]() ���¶����ߣ�
���¶����ߣ�![]() �ܽ�ȵı仯������______
�ܽ�ȵı仯������______![]() ���������С�����䡱
���������С�����䡱![]() ��
��
![]() �����ϱ��ƶ���������Ȼ����ܽ�����ʱ���¶ȷ�Χ��______��
�����ϱ��ƶ���������Ȼ����ܽ�����ʱ���¶ȷ�Χ��______��
![]() ȡ
ȡ![]() ��NaCl���ֹ����36g�ֱ����
��NaCl���ֹ����36g�ֱ����![]() ʱ��100gˮ�г���ܽ⣬
ʱ��100gˮ�г���ܽ⣬![]() ʱ������ͼ1��ʾ��ʵ�������ձ�b���ܽ��������______���ձ�a������Һ���ʵ�����������______
ʱ������ͼ1��ʾ��ʵ�������ձ�b���ܽ��������______���ձ�a������Һ���ʵ�����������______![]() �����ȷ��
�����ȷ��![]() ����Ҫʹ������������������ɲ��õķ�����______��
����Ҫʹ������������������ɲ��õķ�����______��
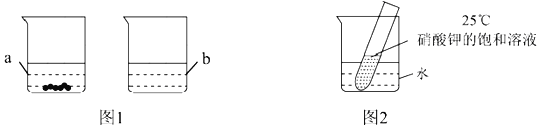
![]() ��ͼ2��ʾ�������ձ��м�������������粒��岢ʹ֮����ܽ⣬���Թ��пɹ۲쵽��������______��
��ͼ2��ʾ�������ձ��м�������������粒��岢ʹ֮����ܽ⣬���Թ��пɹ۲쵽��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ð���(��������������ͬ���Ż��Ϊ40��)̽�������غ㶨�ɵ�ʵ���У�С��ͬѧ���õ�����������ϸ�����ܣ�ϸ�������϶��������ܷ⣬��װ�÷�����ƽ�ϳ���������ΪM1,����ƿȡ�£�ȡ��ϸ�����ܣ��¶˷��ھƾ��ƻ��������������Ⱥ�Ѹ������Ƥ������ƿ����������ȼ���ף�ʵ���������ͼ��ʾ����ش��������⣺
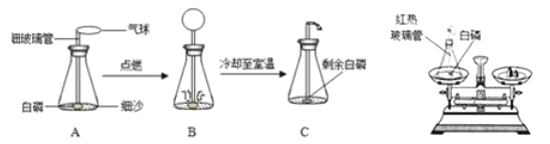
(1)ʵ��۲쵽A��C������Ĵ�С��ͬ��������֪ʶ���Ͳ����������ԭ��______��
(2)����ȼ�չ����У��ܹ۲쵽��������_________________��
(3)С�������ø�װ����֤�����غ㶨�ɣ�����Ҫ���еIJ�����_____________________��
(4)��C�ٴηŵ���ƽ�ϳ�������ƽ��Ȼƽ�⣬�ڴ˻�ѧ��Ӧ�У����۽Ƕȷ�����ƽƽ���ԭ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�òⶨ�����������ĺ�������֪��Y�ι����(��ȥ������ռ�����)Ϊa mL��ע������ˮ�����Ϊb mL��ʵ�鲽�裺��������ԣ��þƾ��Ƽ��Ⱥ�����ȼ�գ���Ӧ��������ȴ��ȡע������ˮ�����Ϊc mL��
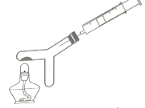
(1)��д������ȼ�յ�ʵ������_____________��
(2)ʵ���в�ÿ����������ĺ���ƫС�����ܵ�ԭ������Щ__________?(д��һ�ּ���)
(3)����ʵ�����ݣ���д�����������������������ļ���ʽ________(�ú���a��b��c��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ڷ��ӡ�ԭ��ˮƽ���о����ʵ���ɡ����ɡ����ʼ���Ӧ�õ�һ�Ż�����Ȼѧ��
(1)��ѧ������ѧϰ�ͽ����Ļ�ѧ�Ļ�֪ʶ��ͨ������.������ѧ�ͻ�ѧ���ű�ʾ��
��һ��������________�� ��ˮ����Ԫ���ԩ�2��________��
��2����ԭ��________�� ��2��������̼����________��
(2)��ͼ��ʾ��![]() ��
��![]() �ֱ��ʾA��B���ֲ�ͬԪ�ص�ԭ�ӣ�ͨ�����·�Ӧʾ��ͼ�ش��������⡣
�ֱ��ʾA��B���ֲ�ͬԪ�ص�ԭ�ӣ�ͨ�����·�Ӧʾ��ͼ�ش��������⡣
�ټ���������________(�����ʷ��࣬��ͬ)������������________��
�ڸ���ͼʾ��Ϣ����ѧ��Ӧǰ��ԭ�Ӹ���________(������������������)
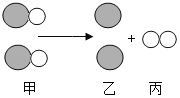
�ۼ����ʵĻ�ѧʽΪ________(��A��B��ʾ)����A��ͨ�����ϼ���+2�ۣ����������BԪ�ػ��ϼ�Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Mn)���仯������;�㷺�����̺Ͻ�(�̸�)�����������������ݵ�������ݶ����ϡ����졢�����ȡ������̵Ļ��������ɫ���ܽ��Լ��±����ش��������⡣
���� | KMnO4 | MnO2 | MnSO4 | Mn(OH)2 | MnO(OH)2 |
��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
�ܽ��� | ���� | ���� | ���� | ���� | ���� |
(1)KMnO4����______________���㷺����ҽҩɱ�����ͷ�������
(2)���ʵ�����������ʯ(Fe2O3)�����̿�(MnO2)����̿��ϼ����¯,ͨ���ȿ�������,�ɵõ����̺Ͻ��û�ѧ����ʽ��ʾ���ɽ����̵Ĺ��̣�
��C + O2![]() CO2���� _______________________���� ________________________��
CO2���� _______________________���� ________________________��
(3)��֪:��MnSO4+2NaOH=Mn(OH)2��+Na2SO4; ��2Mn(OH)2+O2=2MnO(OH)2 ����ʢ��MnSO4��Һ���Թ��м�������NaOH��Һ,����,Ԥ��ɹ۲쵽��������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǿ�ѧ̽������Ҫ;����
(1)�ڳ����ú���ϴ�Ӽ�����ˮ��ϴ�;��ϵ����۱��ô�������ˮҪ��ϴ�ĸɾ��������й���ԭ������к�������_____(�����)��
��ϴ�Ӽ����������� �����ۿ����ܽ���ˮ ��ϴ�Ӽ����黯�Ĺ���
(2)������Һʱ����ʦ����ijͬѧ���Ƶ���������Ϊ10%���Ȼ�����Һ�У��Ȼ�����������С��10%������������Һ��������ƫС��ԭ�������_____��_____(Ҫ��д����)��
(3)ʵ����ѡ������װ����ȡ�����������CO2������֤�䲿�����ʡ�
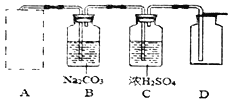
������A�м�Ҫ������CO2����ȡװ��ͼ��_____
��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��Cװ����Ũ�����������_____��
��д����μ���Dװ����CO2���ռ����ķ�����_____
(4)��30.9g�����(KC1O3)�Ͷ������̵Ĺ�������װ���Թ��У�������ȡ������ͬʱ�����Ȼ��ء�����Ӧ��ȫ���Թ���ȴ�����������Եõ�21.3g�������ʡ������ԭ��������������ص�������__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������鸻�������ʡ�̼ˮ�����������֬���ᡢ������(�ơ��ס���)�����岻�ܺϳɵ�8�ֱ��谱���ᡢ���ܲ��ؼ�����ά���صȣ����н�Ƣ�������ʪ�ȹ�Ч������Ӫ����ֵ���߶�����������������֮�ơ�
��������Ĺ��������ǣ������п�������ëù����������(����ˮ�֣�ʹ��������Ӳ��ͬʱ����������������������������ܱ���)����±��װƿ(�γɶ��ط�ζ)���ܷ����Ʒ��������鷢�ͷ�Ϊǰ�����͡�ǰ��������ۻ�øϵ�Ĺ��̣�һ��Ϊ36~48 h�������øϵ�����ڸ�������Ĺ��̣���ʱ�ϳ���һ��Ϊ3��6���¡�
����֡����ϡ�����ʱ��ͺ���ʱ��ȵIJ�ͬ�����鰴ɫ���ζ��Ϊ�츯�顢���顢�ฯ��(����������)��������ȡ��츯��ĺ�ɫ��Ҫ�Ǻ����������ĺ�ɫɫ�أ���������ɫ�ǻ�ͪ�����ʣ���ø�����»��������������ฯ��ĵ���ɫ�ǰ�����ֽ����ɵ�����������ӽ�ϲ����ġ�
���鷢������ʳ�κ����Ի�ѧ��ֵ�Ӱ������ͼ��ʾ��

������ʳ�κ����ʺ����ձ�ϸߣ���Ѫѹ����Ѫ�ܲ���ʹ�硢�������������������ߣ����ٳԻԣ�������ز��顣�����鷢�ͺ����ױ�������Ⱦ����������鶹�����еĵ����ʻ�������������Ļ���������̫��ij����飬Ӱ�����彡����
������������ˮƽ����ߺ��õķ�չ�����ǶԸ��������Ҫ��Խ��Խ�ߡ�
�����������ݣ��ش��������⡣
(1)�����鱻��Ϊ������������������Ϊ__________��
(2)������������Ĺ��������У����������仯����__________��
A�������п� B������ëù C������װƿ D.�ܷⷢ��
(3)�������еĺ���������__________ת�����ɵġ�
(4)�������������У���Ӧ��������ʳ�Σ���������__________��
(5)���й��ڸ����˵���У���������__________��
A�����麬�зḻ�ĵ����� B���ڸ��鷢�����У�pH��С
C����Ѫѹ����Ѫ�ܲ���Ӧ�ٳԻԸ��� D���������ɫ����ͨ��������Ӧ�γɵ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com