
 (1)构建知识网络是化学学习中重要的学习方法,小玲同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)构建知识网络是化学学习中重要的学习方法,小玲同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:分析 (1)根据酸的化学性质,图中①的现象是紫色变红色,若用湿润的PH试纸测定盐酸的PH,酸性减弱,则结果会偏大;图中②是酸与活泼金属的反应,反应的化学方程式:Mg+2HCl=MgCl2+H2↑;铁锈和适量盐酸反应生成氯化铁和水;
(2)首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法和步骤写出物质的化学式即可.
解答 解:(1)①紫色石蕊试液遇酸变红,故图中①的现象是紫色变红色;
②若用湿润的PH试纸测定盐酸的PH,酸性减弱,则结果会偏大;
③图中②是酸与活泼金属的反应,反应的化学方程式:Mg+2HCl=MgCl2+H2↑;
④铁锈和适量盐酸反应生成氯化铁和水,化学和方程式:Fe2O3+6HCl═2FeCl3+3H2O;
(2)①水是一种最常用的 溶剂,化学式为:H2O;
②氧化钙能与水反应生成氢氧化钙,是可用作食品干燥剂的氧化物,其化学式为:CaO;
③厨房中常用的一种酸是醋酸,化学式为:CH3COOH;
④电离时生成的阴离子全部是氢氧根离子的化合物是碱.故填:OH-
故答案为:(1)①紫色变红色;
②偏大;
③Mg+2HCl=MgCl2+H2↑;
④Fe2O3+6HCl═2FeCl3+3H2O;
(2)①H2O;
②CaO;
③CH3COOH;
④OH-.
点评 本考点考查了化学方程式的书写、酸的性质等,要加强练习,理解应用.本考点主要出现在选择题和填空题中.


科目:初中化学 来源: 题型:选择题
| A. | M溶液一定是不饱和溶液,M l溶液一定是饱和溶液 | |
| B. | Ml溶液、M2溶液都一定是饱和溶液 | |
| C. | t℃时M的溶液度一定是50克 | |
| D. | M1可能是饱和溶液,M2一定是饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
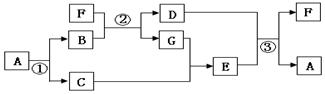
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
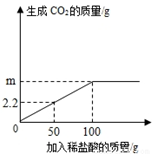 为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如图所示.
为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如图所示. 查看答案和解析>>
科目:初中化学 来源: 题型:解答题
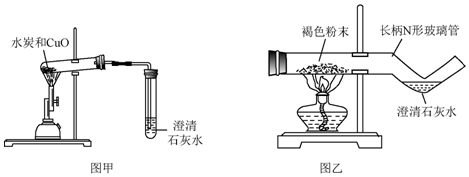
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是某种胃药的部分标识.胃药中所含物质能中和胃液里过多的胃酸(主要是盐酸).
如图是某种胃药的部分标识.胃药中所含物质能中和胃液里过多的胃酸(主要是盐酸).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com