
【题目】高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜粉氧化法获取高纯度氧化铜的流程图.
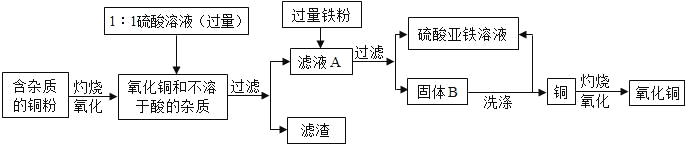
回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把_____慢慢注入_____中,并不断搅拌.
(2)写出硫酸与氧化铜反应的化学方程式:_____.
(3)写出滤液A中发生的化学反应方程式:_____,反应类型是_____
(4)写出固体B所含的物质:_____.
(5)洗涤固体B应使用的试剂是_____.
【答案】浓硫酸 水中 H2SO4+CuO═CuSO4+H2O Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu 置换反应 铁和铜 稀硫酸
【解析】
(1)浓硫酸溶于水会放出大量的热,配制稀硫酸溶液时,一定要把浓硫酸慢慢注入水中,并不断搅拌;
(2)硫酸与氧化铜反应的化学方程式:H2SO4+CuO═CuSO4+H2O;
(3)过量的硫酸和氧化铜反应产生硫酸铜和水,所以A溶液中溶质含有硫酸铜和过量的硫酸;加入铁粉,铁和硫酸及硫酸铜反应,反应的方程式分别为:Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu,都是单质和化合物反应生成新的单质和新的化合物,为置换反应;
(4)滤液A的主要成分是硫酸铜溶液和硫酸,向里面加入过量的铁粉,反应后的固体就是铁和铜的混合物;
(5)洗涤固体B的目的是除去铜粉中的铁粉,并生成硫酸亚铁,故应使用的试剂是稀硫酸。


科目:初中化学 来源: 题型:
【题目】向一定质量的5%的氢氧化钠溶液中加入66.9g硫酸铜溶液,恰好完全反应,得到4.9g蓝色沉淀。请计算:
(1)所用氢氧化钠溶液的质量________。
(2)反应后所得溶液的溶质质量分数__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是
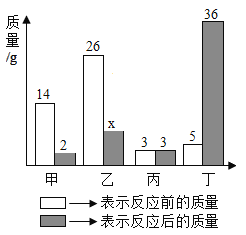
A. 参加反应的甲和乙质量比为2:7 B. 丙可能是该反应的催化剂
C. 丁一定是化合物 D. x的值是7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中科院研制出一种将二氧化碳转化为汽油的方法,其流程如图所示。(下图中 a、b 是两种起始反应物 的分子模型,c、d 是最终制得的汽油中所含两种物质的分子模型)
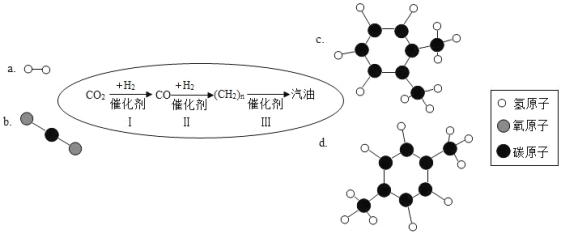
(1)物质 d 中碳元素与氢元素的质量比为________。
(2)汽油常作为汽车的燃料,在汽油机工作的吸气冲程中,需要将汽油雾化,从燃烧的角度分析其目的 是________。
(3)请从原料或产品的角度,分析该成果能够解决的现实问题是__________(答出一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中我们常常会遇到一些棘手的事情,需要用科学方法处理。如:
(1)蚊子、蜂、蚂蚁等昆虫叮咬人后,会向人体注入一种物质R,使皮肤红肿疼痛。为了测定R物质的性质,有同学首先向盛有氢氧化钠溶液的锥形瓶里滴入酚酞溶液,溶液变成________色,然后继续往锥形瓶中逐滴加入R溶液并振荡,当加到一定量时溶液的颜色全部褪去。由此可以推断,R是一种________性的物质,要消除肿痛,可涂抹下列物质中的________。
A食用醋 B食用油 C稀氨水或肥皂水 D氢氧化钠溶液 E稀的石灰水溶液
(2)家用热水壶(铝制)长时间使用后内壁会有一层水垢,主要成分是Mg(OH)2和CaCO3。用盐酸可以除去水垢操作时,一定要注意好盐酸的用量和操作方法,否则水壶会穿孔。说明穿孔的原理___,写出有关反应的化学方程式_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E为初中化学常见的五种物质,它们之间存在如下图所示的关系(“→“表示物质经一步反应可转化为另一种物质,“—“表示相两物质能发生化学反应,部分反应物、生成物及反应条件已略去),请回答下列问题。
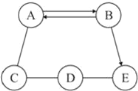
(1)若A、B为组成元素相同的气体,E为大理石的主要成分,则B的化学式为_________,物质D的类别为______(填酸、碱、盐或氧化物)。
(2)若A是能供给人类呼吸的气体,B在常温下呈液态,D的水溶液显蓝色
①C-D反应的化学方程式是____________________________________________。
②B→E反应的化学方程式是___________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】交警通常用一种“酒精检测仪”检查司机呼出的气体中的酒精含量是否超标,其反应原理为:C2H5OH+4CrO3+6H2SO4=2X+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物X,则X的化学式为
A. ![]() B.
B. ![]() C.
C. ![]() D. CrS
D. CrS
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验________(填实验编号)中硫酸镁完全反应。
(2)100g混合溶液中含MgSO4的质量为___(写出计算过程)。
(3)分析实验数据,在下图中,画出加入4%NaOH溶液质量0—30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包含有氧化铜和碳粉的黑色粉末,为了探究该粉末的组成,取10g黑色粉末加入到98g的稀硫酸中,恰好完全反应后得到残留固体质量为2g。试计算:
(1)10g粉末中氧化铜的质量为______g
(2)所用稀硫酸的溶质质量分数为_________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com