
【题目】钢铁行业是我国国民经济的支柱性产业,我国钢铁生产总量占世界钢铁生产总量的50%以上。
⑴钢是一种铁合金,其硬度比纯铁________(填“大”或“小”),钢铁生锈实际是铁与空气中的________发生了化学反应。请写出一种能防止钢铁生锈的措施______________。
⑵下图是某兴趣小组用实验室装置模拟炼铁的化学原理图,用于测定赤铁矿中氧化铁的质量分数。
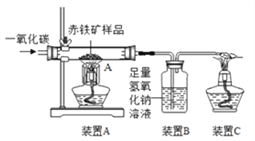
①装置A中发生反应的化学方程式为___________;装置B中发生反应的化学方程式为________;装置C的作用是______________;
②装置气密性良好,假设反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg,则要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是____________或_____________。
⑶某研究性学习小组将Fe和Fe2O3的混合物与稀硫酸反应以测定混合物中Fe2O3的质量分数。称取样品27.2g,与质量分数为20%的稀硫酸充分反应,当加入196g稀硫酸时固体粉末恰好完全溶解,此时收集到0.2g氢气,请写出Fe和Fe2O3分别与稀硫酸反应的化学方程式__________、_________。
【提出疑问】小明根据已有知识推断固体溶解后溶液中的溶质为Fe2(SO4)3和________,并据此计算出铁的质量5.6g,进一步计算发现需要硫酸的总质量比实际消耗的________(填“多”或“少”)。
【查阅资料】Ⅰ、含Fe3+的溶液中滴加硫氰化钾(KSCN)溶液后溶液呈红色;含Fe2+的溶液中滴加硫氰化钾溶液后溶液无明显现象。
Ⅱ、Fe2(SO4)3+Fe= 3FeSO4
【继续探究】小明向反应后的溶液中滴加KSCN溶液,无明显现象。则溶液中肯定不含________。
【分析计算】计算出27.2gFe和Fe2O3的混合物中Fe2O3的质量分数______。(写出计算过程)
【答案】 大 氧气和水 表面涂油、刷漆等 Fe2O3+3CO 高温2Fe+3CO2 2NaOH+CO2═Na2CO3+H2O 除去未反应的CO,防止污染空气 反应后装置A中药品的质量 测出反应前后装置B增加的质量 Fe+H2SO4= FeSO4+H2↑ Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O FeSO4 多 Fe2(SO4)3 58.8%
【解析】⑴合金的硬度、强度、耐腐性通常比纯金属的高;铁生锈是铁与氧气、水共同作用的结果,所以防锈的方法有隔绝氧气、保持金属表面洁净干燥、改变金属的组成和结构(制成合金);⑵①装置A中一氧化碳和氧化铁反应生成铁和二氧化碳,发生反应的化学方程式为Fe2O3+3CO ![]() 2Fe+3CO2;装置B中氢氧化钠和二氧化碳发生反应生成碳酸钠,化学方程式为2NaOH+CO2═Na2CO3+H2O;装置C的作用是点燃尾气中的一氧化碳,防止污染空气;②如反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg,则要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是反应后装置A中药品的质量(固体减少的质量即为氧化铁中氧元素的质量,根据氧化铁的化学式计算氧化铁中氧元素的质量分数,氧元素的质量除以氧化铁中氧元素的质量分数就是氧化铁的质量,氧化铁的质量除以wg,即可得赤铁矿样品中氧化铁的质量分数)或测出反应前后装置B增加的质量(增加的质量就是反应生成二氧化碳的质量,由化学方程式计算出氧化铁的质量,氧化铁的质量除以wg,即可得赤铁矿样品中氧化铁的质量分数);⑶铁和硫酸反应生成硫酸亚铁和氢气,反应方程式为:Fe+H2SO4= FeSO4+H2↑;氧化铁和硫酸反应生成硫酸铁和水,反应方程式为:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;【提出疑问】根据铁、氧化铁与硫酸的反应方程式可推断固体溶解后溶液中的溶质为Fe2(SO4)3和FeSO4,由生成氢气的质量为0.2g,可计算出单质铁的质量5.6g
2Fe+3CO2;装置B中氢氧化钠和二氧化碳发生反应生成碳酸钠,化学方程式为2NaOH+CO2═Na2CO3+H2O;装置C的作用是点燃尾气中的一氧化碳,防止污染空气;②如反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg,则要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是反应后装置A中药品的质量(固体减少的质量即为氧化铁中氧元素的质量,根据氧化铁的化学式计算氧化铁中氧元素的质量分数,氧元素的质量除以氧化铁中氧元素的质量分数就是氧化铁的质量,氧化铁的质量除以wg,即可得赤铁矿样品中氧化铁的质量分数)或测出反应前后装置B增加的质量(增加的质量就是反应生成二氧化碳的质量,由化学方程式计算出氧化铁的质量,氧化铁的质量除以wg,即可得赤铁矿样品中氧化铁的质量分数);⑶铁和硫酸反应生成硫酸亚铁和氢气,反应方程式为:Fe+H2SO4= FeSO4+H2↑;氧化铁和硫酸反应生成硫酸铁和水,反应方程式为:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;【提出疑问】根据铁、氧化铁与硫酸的反应方程式可推断固体溶解后溶液中的溶质为Fe2(SO4)3和FeSO4,由生成氢气的质量为0.2g,可计算出单质铁的质量5.6g
设5.6g完全反应消耗硫酸的质量为x
Fe + H2SO4= FeSO4+H2↑
56 98
5.6g x
![]() x=9.8g 则需要硫酸溶液的质量为:9.8g÷20%=49g
x=9.8g 则需要硫酸溶液的质量为:9.8g÷20%=49g
设氧化铁反应的硫酸质量为y
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
160 294
27.2g-5.6g y
![]() y=39.69g 则需要硫酸溶液的质量为:39.69g÷20%=198.45g
y=39.69g 则需要硫酸溶液的质量为:39.69g÷20%=198.45g
共消耗硫酸溶液:49g+198.45g>196g
【继续探究】由题中信息可知:含Fe3+的溶液中滴加硫氰化钾(KSCN)溶液后溶液呈红色;含Fe2+的溶液中滴加硫氰化钾溶液后溶液无明显现象。向反应后的溶液中滴加KSCN溶液,无明显现象。则溶液中肯定不含Fe3+;
【分析计算】由于最终铁元素都以硫酸亚铁的形式存在,设铁元素的总质量为m
H2SO4 ~ FeSO4 ~ Fe
98 56
196g m
![]() x=22.4g
x=22.4g
其中有5.6g铁与硫酸反应生成氢气,其余的铁来自于Fe2(SO4)3+Fe= 3FeSO4,由化学方程式可知三分之一的铁是该反应中的单质铁,三分之二的铁是硫酸铁中,即氧化铁中的铁(因氧化铁和硫酸生成硫酸铁和水),因此可知氧化铁中的铁元素是11.2g,设氧化铁的质量为n,
2Fe ~ Fe2O3
112 160
11.2g n
112/11.2g=160/n n=16g
即27.2gFe和Fe2O3的混合物中Fe2O3的质量为16g,混合物中氧化铁的质量分数为:
16g ÷27.2g×100%≈58.8%。
答:混合物中Fe2O3的质量分数为58.8%


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:初中化学 来源: 题型:
【题目】下列四个图像中,不能正确表示对应变化关系的是 ( )
|
|
|
|
A.向一定量稀硫酸中加水稀释 | B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C.加热一定质量的 高锰酸钾固体 | D.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A、B、C三种固体物质的溶解度曲线。

(1)溶解度随温度升高而明显增大的物质是_________。
(2)t1℃时,三种物质溶解度的大小关系是_________。
(3)A中含有少量C,提纯A采用的方法是_________。
(4)t2℃时,A和B各40g分别加入100g水中,充分搅拌,不能形成饱和溶液的是______。要使该不饱和溶液变为饱和溶液,除了增加溶质,还可以采用的一种方法是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图分别是钾元素、氢元素、氧元素、钠元素的原子结构示意图
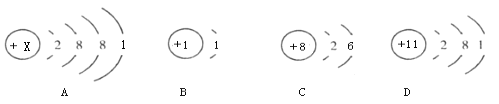
(1)A中X的值为________;
(2)A、D化学性质相似的原因是_____________;
(3)如图氧元素、氢元素的质子数分别为8和1,则一个OH- (氢氧根离子)的质子数为_________;
(4)AC形成的物质的化学式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年5月,中国科学家取得了将二氧化碳在一定条件下转化为化工原料的重大特破。二氧化碳和氢气反应制取乙烯,其反应的微观过程如下图所示。下列说法的是 ( )
A. 生成物分子数之比是1:2:4 B. 反应前后分子种类、数目均不变
C. 乙烯的化学式为C2H4 D. 无机物不能转化为有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C、D四种粒子的结构示意图。
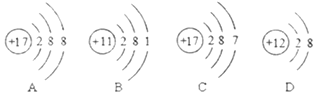
![]() 、B、C、D所示粒子共表示______种元素
、B、C、D所示粒子共表示______种元素![]() 填数字
填数字![]() 。
。
![]() 所示粒子在化学反应中容易电子______
所示粒子在化学反应中容易电子______![]() 填“得到”或“失去”
填“得到”或“失去”![]() 。
。
![]() 与D形成的化合物的化学式是______。
与D形成的化合物的化学式是______。![]() 用字母“A、D”或元素符号表示均可
用字母“A、D”或元素符号表示均可![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验加试中同学发现:向澄清石灰水中吹入![]() ,产生白色沉淀,再不断吹入
,产生白色沉淀,再不断吹入![]() ,沉淀全部溶解。同学们对白色沉淀溶解的生成物展开如下探究:
,沉淀全部溶解。同学们对白色沉淀溶解的生成物展开如下探究:
活动一:探究白色沉淀溶解的生成物是什么?
【查阅资料】碳酸钙、水和二氧化碳反应可生成碳酸氢钙。请完成资料里所涉及的化学方程式______。
活动二:探究碳酸氢钙具有哪些化学性质?
请你就碳酸氢钙可能具有的化学性质提出两个猜想并设计实验加以验证。可供使用的试剂和仪器为:![]() 溶液、
溶液、![]() 溶液、澄清石灰水、稀盐酸、NaOH溶液、试管、烧杯、导管、玻璃棒。
溶液、澄清石灰水、稀盐酸、NaOH溶液、试管、烧杯、导管、玻璃棒。
序号 | 猜想 | 操作步骤 | 可能观察到的现象 |
一 | ___________ | ___________ | ___________ |
二 | ___________ | ___________ | ___________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是硫酸铜溶液与锌粒反应前后溶液中主要离子变化示意图。
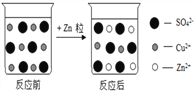
(1)锌与硫酸铜溶液发生反应中变化的微观粒子是____________。
(2)反应中过量的物质是__________(写化学式)。
(3)该反应的化学方程式为______________,反应现象为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某品牌奶粉包装袋上的部分信息,下列解读错误的是:
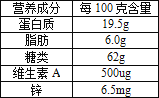
A. 吃奶粉最主要目的是补充蛋白质
B. 营养成分中的“锌”是人体必需的微量元素
C. 维生素可调节新陈代谢、预防疾病
D. 每100克奶粉中脂肪提供的能量最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com