
| A. | 硫在空气中燃烧发出明亮的蓝紫色火焰 | |
| B. | 电解水的实验中负极产生的气体使带火星的木条复燃 | |
| C. | 黄铜片和铜片相互刻划,只有铜片上有划痕 | |
| D. | 生石灰加入一定体积的水,白色固体变成白色浆液,吸收大量的热 |
分析 A、根据硫在氧气中燃烧产生蓝紫色的火焰进行解答;
B、根据电解水的实验中负极产生的气体是氢气进行解答;
C、根据合金的硬度大进行解答;
D、根据生石灰和水反应生成氢氧化钙,且放出大量的热进行解答.
解答 解:A、硫在空气中燃烧发出淡蓝色的火焰,而硫在氧气中燃烧产生蓝紫色的火焰,故A错误;
B、电解水的实验中负极产生的气体是氢气,氢气能燃烧,发出淡蓝色的火焰,而不能使带火星的木条复燃,故B错误;
C、黄铜的硬度大,所以黄铜片和铜片相互刻划,只有铜片上有划痕,故C正确;
D、生石灰和水反应生成氢氧化钙,且放出大量的热,故D错误.
故选C.
点评 本题主要考查了如何正确的判断实验现象及其实验结论等方面的内容.完成此题,可以依据物质的性质进行.要求同学们加强对基础知识的储备,以便灵活应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 操作方式 |
| A | H2(水蒸气) | 通过装有浓硫酸的洗气瓶 |
| B | CO(O2) | 缓慢通过灼热铜网 |
| C | NaCl溶液(Na2CO3) | 滴加盐酸至恰好不再产生气泡为止 |
| D | CaCl2溶液(HCl) | 加入足量CaCO3固体充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 今年世界环境日中国的主题是:“改善环境质量,推动绿色发展.”
今年世界环境日中国的主题是:“改善环境质量,推动绿色发展.”| 燃料 | 一氧化碳 | 氢气 | 甲烷 |
| 热量(kJ) | 282.6 | 285.8 | 890.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al(NO3)3 | B. | CaCO3 | C. | Al2(SO4)3 | D. | Fe(NO3)3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量(g) | 7.6 | 2.0 | 0.2 | 0 |
| 反应后的质量(g) | 3.2 | X | 5.8 | 0.4 |
| A. | X=0.4 | |
| B. | 丁一定是单质 | |
| C. | 甲和乙是反应物 | |
| D. | 反应中的甲、丙发生改变的质量比是11:14 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

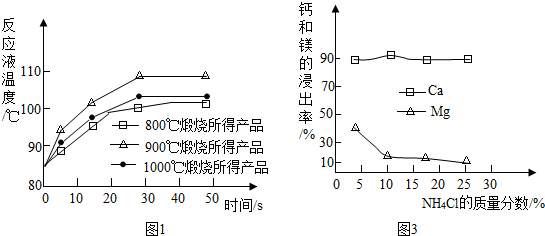
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图为甲、乙两物质的溶解度曲线,下列说法正确的是( )
如图为甲、乙两物质的溶解度曲线,下列说法正确的是( )| A. | 甲、乙两物质均属于难溶物质 | |
| B. | 甲物质的溶解度大于乙物质的溶解度 | |
| C. | t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等 | |
| D. | t2℃时,甲物质饱和溶液的溶质质量分数为50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com