石灰石的主要成分是碳酸钙.欲测定某石灰石样品中碳酸钙的质量分数.请回答下列问题:
(1)将石灰石粉碎,加入稀盐酸后发生反应的化学方程式是
(2)若取12.5克石灰石粉末放在烧杯里,然后往烧杯中加入刚配制的稀盐酸100克,恰好完全反应后,称得反应剩余物为108.1克.(假设其他物质不与盐酸反应),求解石灰石中碳酸钙质量(X)的比例式为
(3)此石灰石样品中碳酸钙的质量分数为
(4)若某建筑工地需要生石灰224吨,在高温煅烧过程中,共损失钙20%,则需这种石灰石的质量是 .
【答案】
分析:(1)石灰石的主要成分为碳酸钙,碳酸钙和盐酸反应生成了氯化钙、水和二氧化碳,可以据此解答该题;
(2)根据质量守恒定律可以计算出生成的二氧化碳的质量,然后结合反应的化学方程式可以列出求算碳酸钙的比例式;
(3)利用(2)的比例式可以计算出碳酸钙的质量,进而计算才碳酸钙的质量分数;
(4)根据钙元素的质量守恒可以计算出石灰石的质量.
解答:解:(1)石灰石的主要成分为碳酸钙,碳酸钙和盐酸反应生成了氯化钙、水和二氧化碳,该反应的化学方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(2)根据质量守恒定律可以知道生成二氧化碳的质量为:12.5g+100g+-108.1g=4.4g,
设石灰石中碳酸钙的质量为x,则:
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 44
x 4.4g

解得:x=10g
(3)石灰石中的质量分数为:
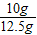
×100%=80%;
(4)设需要石灰石的质量为y,则根据钙元素的质量守恒可以知道:
y?80%×

×100%×(1-20%)=224t×

×100%
解得:y=625t
故答案为:(1)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(2)
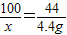
;
(3)80%;
(4)625t.
点评:根据化学方程式进行计算时,所使用的物质的质量均为纯净物的质量,不纯净的物质的质量不能直接代入化学方程式进行计算.


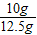 ×100%=80%;
×100%=80%; ×100%×(1-20%)=224t×
×100%×(1-20%)=224t× ×100%
×100%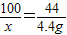 ;
;
