
【题目】氢化钙(CaH2)是种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是________(填写化学式)。
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
(提出猜想)猜想一:NaOH: 猜想二:NaOH和Na2CO3;
猜想三:________________; 猜想四:NaOH、Na2CO3、Ca(OH)2
经过分析,大家一致认为上述猜想_______不需要验证,肯定是错误的,原因是(用化学方程式表示)___________________________。
(实验探究)
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生。
(讨论交流)根据实验现象,得出猜想________是正确的。请解释方案一中无明显现象的原因是_____________________________。
(拓展探究)上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(1)样品中CaH2的质量分数为____。
(2)原碳酸钠溶液中溶质的质量为____。
(3)反应后溶液中溶质的质量分数为____。(计算结果保留一位小数)
【答案】CaCO3 NaOH、Ca(OH)2 四 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 二 稀盐酸的量很少,先全部与氢氧化钠反应了 84% 10.6g 18.3%
【解析】
将一定量的CaH2加入到碳酸钠溶液中,氢化钙先与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,然后碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是CaCO3。
提出猜想:
猜想一:NaOH;猜想二:碳酸钠过量,NaOH和Na2CO3;猜想三:氢化钙过量,NaOH、Ca(OH)2;猜想四:NaOH、Na2CO3、Ca(OH)2;猜想四不需要验证,肯定是错误的,原因是碳酸钠和氢氧化钙不能共存,化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓。
讨论交流:
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。因为稀盐酸为少量的,所以可能溶液中的存在氢氧化钠先和稀盐酸反应,所以不能判断三个猜测是否正确。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生,生成的色沉淀是碳酸钠和氯化钡反应生成的碳酸钡沉淀。故猜想二正确。
拓展探究:
上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。
解:设氢化钙样品中氢化钙的质量为x,生成的氢氧化钙的质量为y,参与反应的碳酸钠的质量为z,生成的氢氧化钠为m,生成碳酸钙的质量为n,
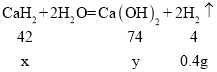
![]() ,解得x=4.2g,y=7.4g,杂质=5g-4.2g=0.8g,样品中CaH2的质量分数为
,解得x=4.2g,y=7.4g,杂质=5g-4.2g=0.8g,样品中CaH2的质量分数为![]() =84%。
=84%。
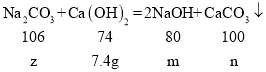
z=10.6g,m=8g,n=10g,故原碳酸钠溶液中溶质的质量为10.6g,反应后放入溶质为氢氧化钠,反应后溶液中溶质的质量分数为![]() ×100%
×100%![]() 18.3%。
18.3%。
答:(1)样品中CaH2的质量分数为84%。
(2)原碳酸钠溶液中溶质的质量为10.6g。
(3)反应后溶液中溶质的质量分数为18.3%。


科目:初中化学 来源: 题型:
【题目】如图是实验室制取气体的部分装置,请回答下列问题:
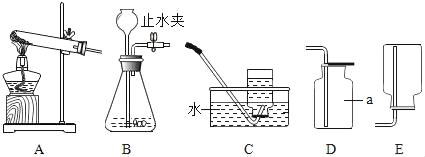
(1)图示装置中仪器a的名称是_____;
(2)若要收集较为纯净的氧气最好选用_____(填字母序号,以下同)作为收集装置;
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。已知常温下氨气是一种无色、密度比空气小的气体。氨气极易溶于水,其水溶液呈碱性。如果实验室要制取并收集瓶氨气,应该选择的装置是_____。干燥氨气时不能选用下列干燥剂中的_____。
A 固体氢氧化钠 B 浓硫酸 C 生石灰
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在A+B![]() C+D的反应中,下列叙述错误的是
C+D的反应中,下列叙述错误的是
A. 若C和D为盐和水,该反应不一定是中和反应
B. 若A是氧化铜、C为铜,该反应不一定是置换反应
C. 若将20gA和30gB混合,则生成C和D的总质量一定为50g
D. 此反应可能是复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源,日常生活、工农业生产和科学实验都离不开水。
(1)下图中的海水属于__________(填“纯净物”或“混合物”)。
(2)如下图所示,利用海水提取粗盐的过程中,析出晶体后的母液是氯化钠的__________(填“饱和”或“不饱和”)溶液。
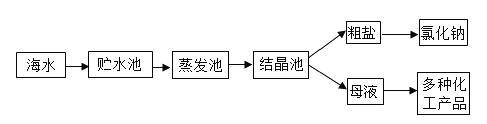
(3)河水是重要的陆地淡水资源,经处理后可用作城市生活用水,自来水厂净水的过程中不包括下列哪种净水方法__________(填字母序号)。
A沉淀 B过滤 C蒸馏 D吸附
(4)生活中,人们常用__________来检验水样品是硬水还是软水。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知氧化铜还原成铜的过程中有氧化亚铜生成。如图是小华同学用CO还原氧化铜的实验装置图,当玻璃管中黑色物质全部变红后,小华想知道红色物质中有哪些成分?请你与小华一起完成下面的探究。
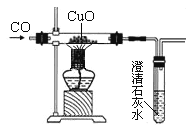
【提出猜想】①全部是铜; ②全部是氧化亚铜;③是铜和氧化亚铜的混合物。
【查阅资料】氧化亚铜是一种红色固体,能与稀硫酸发生如下反应:
Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验】为了验证这些猜想,小华同学进行了以下探究活动,请完成下列问题:
步骤 | 现象或数据 | 结论 |
(1)称取14.4g反应生成的红色固体于试管中,向其中加入足量的稀硫酸; | 现象:_______; | 猜想①错误 |
(2)将步骤(1)反应后的物质进行过滤,称量干燥后的固体质量为m。 | 数据: 若m = 6.4g; | ________ |
数据:若m_______6.4g (填:>、<或=)。 | 猜想③正确 |
【交流反思】(1)小华实验装置中的石灰水的主要作用是______________________________,从环保角度看,该装置有待改进,请写出一种改进措施_____________________________。
(2)请写出氧化铜与CO反应生成氧化亚铜的化学方程式_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】农作物秸秆属于农业生态系统中一种十分宝贵的生物质能资源。农作物秸秆综合利用对于促进农民增收、环境保护、资源节约以及农业经济可持续发展意义重大。秸秆的主要成分是纤维素[(C6H10O5)n]。
(1)纤维素分子中C、H、O原子个数比为_________。
(2)发电厂将秸秆粉碎压缩成颗粒,作为燃料用于发电。如果直接在农田中燃烧秸秆的主要危害是_________。
(3)将秸秆还田,可作为农家肥料,但某植物在生长过程中还需要施用复合肥。下列属于复合肥的是_________(填标号)。
A KNO3 B CO(NH2)2 C NH4NO3 D NH4H2PO4
(4)以秸秆为原料可生产出可降解塑料餐盒;该塑料属于_________(选填“合成有机高分子”、“天然有机高分子”、“合金”)材料
(5)利用秸秆可生产乙醇,加入到汽油中制成乙醇汽油。生产过程中涉及到如下反应C6H12O6![]() 2C2H5OH+2X↑,则X的化学式为_________。
2C2H5OH+2X↑,则X的化学式为_________。
(6)在农村,秸秆曾经作为燃料广泛使用,但秸秆不完全燃烧会产生_________气体与血液中的血红蛋白结合引起中毒。随着社会的进步,农村可以推广使用下列哪些能源替代秸秆作燃料_________。
A 沼气 B 天然气(或液化气) C 太阳能
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中A~G是初中化学常见的物质。在常温下,A、D是气体,B、C是液体,E、F是固体;组成B、C的元素种类相同,组成E、F的元素种类也相同。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
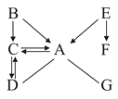
(1)写出化学式:B____。
(2)写出D的一点用途____。
(3)写出E→F的化学方程式____。
(4)G与A反应时剧烈燃烧,火星四射,生成黑色固体,
化学方程式为____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com