
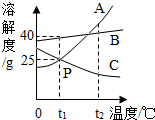
 如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水):
如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水):分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,P点的含义是:t1℃时,A、C物质的溶解度相等;
(2)t1℃时,B物质的溶解度是40g,将30g物质B加入到30g水中,得到B的饱和溶液,该溶液中溶质的质量分数为$\frac{40g}{140g}$×100%=28.6%;
(3)t2℃时,A物质的溶解度最大,C物质的溶解度最小,所以用等质量的A、B、C三种物质分别配制饱和溶液,得到是那种溶液的质量由小到大的顺序是ABC.
故答案为:(1)t1℃时,A、C物质的溶解度相等;
(2)饱和,28.6%;
(3)ABC.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质:金刚石、水银、钢 | B. | 碱:烧碱、纯碱、熟石灰 | ||
| C. | 氧化物:水、干冰、过氧化钠 | D. | 酸:硫酸、硝酸、碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO42-、Cl-、Na+、H+ | B. | K+、SO42-、Cu2+、NO3- | ||
| C. | SO42-、Cl-、K+、Na+、 | D. | Ca2+、CO32-、Na+、Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 初三实验操作考试结了,某班同学清理实验室时,发现如下三个内壁都有白色固体的细口瓶,曾经装过标签标示的溶液.同学们想探究白色固体的成分,设计如下实验.
初三实验操作考试结了,某班同学清理实验室时,发现如下三个内壁都有白色固体的细口瓶,曾经装过标签标示的溶液.同学们想探究白色固体的成分,设计如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com