

 CaCl2 +2H2O+ 2NH3↑
CaCl2 +2H2O+ 2NH3↑ 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O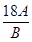 -16
-16

科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
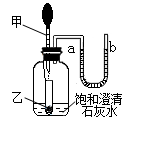
| A.甲、乙一定分别是稀盐酸和碳酸钙固体 |
| B.甲、乙有可能分别是水和硝酸铵固体 |
| C.石灰水变浑浊有可能是发生了物理变化 |
| D.一定是CO2与澄清石灰水反应生成沉淀 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
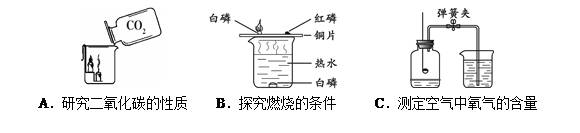
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
 氧气
氧气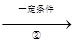 氧化物甲”的转化,反应I的化学方程式为 。
氧化物甲”的转化,反应I的化学方程式为 。
| A.澄清石灰水变浑浊 | B.反应前后D中质量减轻 |
| C.F导管口有蓝色火焰 | D.加热时,四氧化三铁变红 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
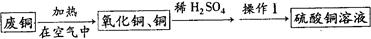
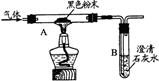
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
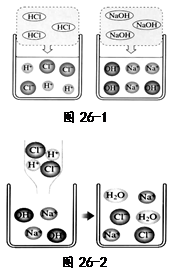
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com