

| 物 质 | Cu(OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 1.2 |
| 完全沉淀pH | 6.7 | 3.2 |
分析 (1)根据亚铁离子不容易除去,加入氯酸钠将亚铁离子转化成铁离子,然后通过控制pH值将铁离子转化成滤渣氢氧化铁沉淀除去进行分析;
(2)根据调节的pH值使铜离子不能沉淀,铁离子开始出现沉淀进行分析;
(3)根据反应温度过高,碳酸铜和氢氧化铜都会分解生成氧化铜进行分析;
(4)根据检验氯离子需要用硝酸酸化的硝酸银检验进行分析;
(5)根据无水硫酸铜遇水变蓝色,氢氧化钠会与二氧化碳反应,碱石灰会与二氧化碳和水反应进行分析;
(6)根据样品的质量必须称量,aCuCO3•bCu(OH)2•cH2O中包括三部分,知道其中两部分的数据,另一部分的数据可以通过样品质量和已知两部分的质量求得进行分析;
(7)根据空气中的二氧化碳会与氢氧化钠反应,而使碳酸铜质量增大进行分析.
解答 【分析】解:(1)亚铁离子不容易除去,加入氯酸钠将亚铁离子转化成铁离子,然后通过控制pH值将铁离子转化成滤渣氢氧化铁沉淀除去,所以滤渣的主要成分是Fe(OH)3.
故填:Fe (OH)3.
(2)调节的pH值使铜离子不能沉淀,铁离子开始出现沉淀,通过分析表中的数据可以看出,铜离子在pH值是4.2时,开始沉淀,铁离子在pH值是3.2时,开始沉淀,所以调节反应A后溶液的pH范围应为:3.2-4.2.
故填:3.2~4.2.
(3)反应温度过高,碳酸铜和氢氧化铜都会分解生成氧化铜,所以反应B的温度如过高,则所得蓝绿色产品中可能会出现的黑色固体是CuO.
故填:CuO.
(4)检验氯离子需要用硝酸酸化的硝酸银检验,所以过滤得到的产品可用蒸馏水洗涤,为检验是否洗涤干净,可取最后一次洗涤液,先加入硝酸银溶液,再加入稀硝酸,观察到没有明显现象,则表明已洗净.
故填:硝酸银溶液;稀硝酸;不产生白色沉淀.
(5)无水硫酸铜遇水变蓝色,氢氧化钠会与二氧化碳反应,碱石灰会与二氧化碳和水反应,所以B中的试剂是无水硫酸铜,C中的试剂是氢氧化钠溶液,D中的试剂是碱石灰.
故填:c;d;a.
(6)样品的质量必须称量,aCuCO3•bCu(OH)2•cH2O中包括三部分,知道其中两部分的数据,另一部分的数据可以通过样品质量和已知两部分的质量求得,所以可行的组合为abcd;
充分反应后测得:①A中样品质量为12.0g,②A中剩余固体质量为8.0g,③B装置增重1.8g,④C装置增重2.2g,所以氧化铜质量为8g,生成水的质量为1.8g,二氧化碳的质量为2.2g,
aCuCO3•bCu(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)CuO+(b+c)H2O+aCO2↑,
80(a+b) 18(b+c) 44a
8g 1.8g 2.2g
$\frac{80(a+b)}{8g}$=$\frac{18(b+c)}{1.8g}$=$\frac{44a}{2.2g}$,
a:b:c=1:1:1.
故填:abcd;1:1:1.
(7)D的作用:防止空气中的二氧化碳进入C中;
空气中的二氧化碳会与氢氧化钠反应,使氢氧化钠溶液的质量增重偏大,从而使测出的碳酸铜质量增大,即a值偏大.
故填:防止空气中的二氧化碳进入C中;偏大.
点评 在解此类题时,首先分析题中考查的问题,确定使用的知识点,然后结合学过的知识和题中所给的资料进行分析解答.


 口算能手系列答案
口算能手系列答案科目:初中化学 来源: 题型:选择题
| A. | 电解水和氢气燃烧的基本反应类型相同 | |
| B. | 水是水分子构成的纯净物 | |
| C. | 净化水的常用方法有沉降、过滤、吸附和蒸馏 | |
| D. | 在硬水里用肥皂洗衣服会出现泡沫少浮渣多的现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.
自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
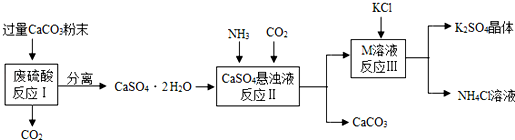
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
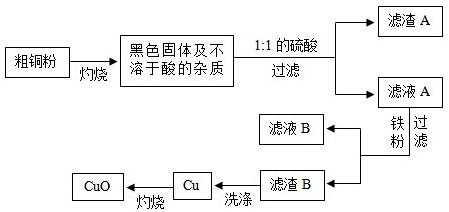
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
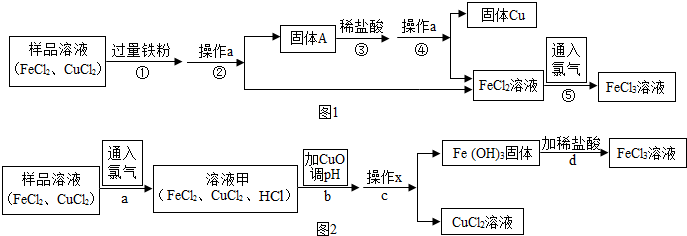
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 离子是带电的原子或原子团 | |
| B. | 水分子是由两个氢元素和一个氧元素构成的 | |
| C. | 分子、原子和离子都是构成物质的微粒 | |
| D. | 原子的质量主要集中在原子核上 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com