
【题目】请根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
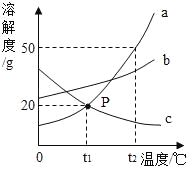
(1)P点的含义是_____。
(2)t2℃时,30g物质a加入到50g水中不断搅拌,得到物质a的_____(填“饱和”或“不饱和”)溶液;此时溶液中溶质的质量分数是_____(精确到0.1%)。
(3)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是_____。
(4)物质a中含有少量的物质b,可采取_____的方法提纯a物质。
【答案】t1℃时,物质a与物质c的溶解度相等 饱和 33.3% c 降温结晶
【解析】
(1)通过分析溶解度曲线可知,P点的含义是:t1℃时,物质a与物质c的溶解度相等;
(2)t2℃时,a物质的溶解度是50g,所以30g物质a加入到50g水中不断搅拌,得到物质a的饱和溶液,50g水最多能溶解25g物质a,溶液中溶质的质量分数![]()
(3)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,降低温度a、b物质的溶解度减小,c物质的溶解度增大,t1℃时a、b物质的溶解度大于t2℃时c物质的溶解度,所以所得溶液中溶质质量分数最小的是c;
(4)a物质的溶解度受温度变化影响较大,所以物质a中含有少量的物质b,可采取降温结晶的方法提纯a物质。


科目:初中化学 来源: 题型:
【题目】已知某物质在20℃ 和40℃ 时的溶解度分别为10g和40g。某温下,将5g该物质加到20g水中,下列有关叙述正确的是
A. 20℃ 时,所得溶液的质量为25g
B. 40℃ 时,所得溶液为饱和溶液
C. 不管什么温度下,所得溶液的溶质质量分数均为20%
D. 该物质的溶解度随温度的升高而增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有盐酸和氯化镁的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。下列说法错误的是
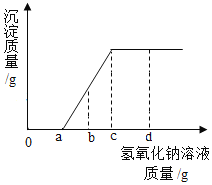
A. 滴加氢氧化钠溶液质量为a~cg时,溶液中发生的反应为:![]()
B. 滴加氢氧化钠溶液质量至ag时,溶液中溶质质量比原混合溶液中溶质质量大
C. 滴加氢氧化钠溶液质量至bg时,溶液中含三种溶质
D. 滴加氢氧化溶液质量至cg时,溶液呈中性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在相同质量、等质量分数的三份稀盐酸中,分别加入①MgO,②Mg(OH)2,③MgCO3三种物质,均能恰好完全反应,分别得到三份无色澄清溶液.则所得溶液中MgCl2的质量分数大小关系的比较,下列正确的是( )
A. ①=③>②B. ①>②>③C. ③>②>①D. ①=②=③
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包固体的混合物,可能含有Na2SO4、Na2CO3、NaCl、NaNO3中的两种或两种以上。小红想知道混合物的成分,便和实验小组同学共同设计以下实验。
A的浓溶液常用作干燥剂。
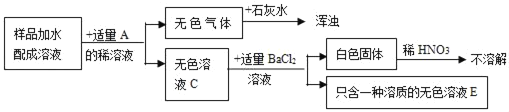
(1)写出B、D的化学式B_____;D_____
(2)向样品中加入A的稀溶液,反应的化学方程式:_____
(3)实验结束了,小红得知混合物的组成可能是(写化学式)(可不填满)
①_____;②_____;③_____;④_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(一)以下工具的制作过程中没有发生化学变化的是_____。
A原始人制作石刀 B冶炼青铜 C炼铁
(二)请将以下金属材料的冶炼按年代的先后顺序排序_____(填序号)。
A铁 B青铜 C铝
从以上顺序可以看出,金属制品的出现顺序与_____有关,那么金属钾的制得应排在_____(填序号)之后。
(三)铜器是生活中常见物品,铜器保存不善,表面会生成一层绿色铜锈Cu2(OH) 2CO3.铜生锈的条件除了水和氧气外还需要_____(写化学式)。
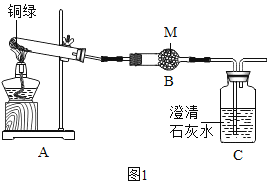
(四)为了探究碱式碳酸铜的化学性质和组成,该小组同学取少量铜绿(假设杂质不参与反应)按如图装置进行实验:
已知:I.铜绿的主要成分是碱式碳酸铜。
Ⅱ.铜器因所处环境不同,生成的铜绿中可能还含有CuSO4和CuCl2。
Ⅲ.硫酸铜、氯化铜的化学性质稳定,酒精灯加热条件下不分解。
(1)M药品的名称是_____。
(2)写出Cu2(OH)2CO3分解的化学方程式_____。
(3)实验过程中,发现A中绿色固体逐渐变为黑色,B中固体变蓝色,C中现象为_____,此处发生反应的化学方程式为_____。
(4)为了验证铜绿中是否有CuSO4和CuCl2,该小组同学进行了如下实验,请补充完成下列实验报告:
步骤 | 操作 | 现象及结论 |
① | 取少量铜绿溶于足量稀硝酸中,并将溶液分成甲、乙两份 | 产生气泡 |
② | 向甲中滴加硝酸钡溶液 | 若观察到_____,则铜绿中含有CuSO4 |
③ | 向乙中加入过量的硝酸钡溶液,振荡、静置,取上层清液于试管中,再滴加_____。 | 若观察到产生白色沉淀,则铜绿中含有CuCl2 |
(五)已知:
①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为 (NH4)xFey(SO4)m(OH)n,其中铁为+3价。
③在化学中Fe3O4可以表示为FeOFe2O3
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图2:
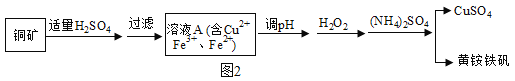
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为_____,111gCu2 (OH)2CO3与稀H2SO4反应时消耗H2SO4的质量为_____g。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取mg样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到0.0425g的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g。
①黄铵铁矾中NH4+与SO42﹣的个数比为_____。
②通过计算确定黄铵铁矾的化学式_____。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液与人们的生产、生活密切相关。
图1为甲、乙两种固体物质的溶解度曲线。
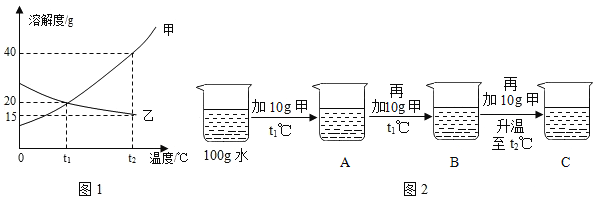
(1)溶解度随温度升高而增大的物质是_____ (填“甲”或“乙”)。
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C三种溶液,在A、B、C三种溶液中属于饱和溶液的是_____(填字母)。 向C中再加入25g 甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为_____(结果精确到0.1%)。
(3)将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数:甲_____乙(填“<”“=”或“>”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种难溶于水和乙醇,在潮湿空气中易变质,广泛应用于冶金、电镀、医药等行业的原料。CuCl的制备流程如下:
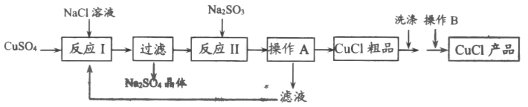
(1)“反应Ⅰ”中发生的化学方程式为_______。
(2)反应Ⅰ“过滤”后所得的滤液中,除了Cu2+, Na+, Cl-外,还存在较多的离子是_______(写离子符号)
(3)“反应Ⅱ”中发生的化学变化是2CuCl2+Na2SO3 +H2O =2CuCl↓+2NaCl+ H2SO4,其中化合价发生改变的元素有_______;反应过程中溶液的pH_______(选填“变大”、“变小”或“不变”)。
(4)本流程中可以循环利用的物质是_______。(写名称)
(5)在洗涤过程中用乙醇而不用水洗涤的原因是_______。
(6)“操作B”的名称是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
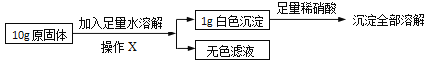
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com