
分析 (1)根据大理石的主要成分为碳酸钙,实验室用它和稀盐酸反应制取二氧化碳进行分析;
(2)根据氢氧化钙可以用来改良酸性土壤,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析;
(3)根据过滤可以除去不溶性杂质,碳酸镁、氧化钙和盐酸反应会生成氯化钙、氯化镁,熔融的氯化镁在通电的条件下生成镁和氯气进行分析;
(4)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,固体减少的质量就是二氧化碳有,然后依据化学方程式计算碳酸钙的质量,进而计算质量分数.
解答 解:(1)大理石的主要成分为碳酸钙,实验室用它和稀盐酸反应制取二氧化碳;
(2)氢氧化钙可以用来改良酸性土壤,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(3)过滤可以除去不溶性杂质,碳酸镁、氧化钙和盐酸反应会生成氯化钙、氯化镁,熔融的氯化镁在通电的条件下生成镁和氯气,化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)生成二氧化碳的质量为:90g+10g-96.7g=3.3g,
设大理石中碳酸盐的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3g}$
x=7.5g
大理石中碳酸盐的质量分数为:$\frac{7.5g}{10g}$×100%=75%.
故答案为:(1)碳酸钙,稀盐酸;
(2)酸性土壤,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(3)过滤,氯化钙、氯化镁,MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)大理石中碳酸盐的质量分数为:75%.
点评 解答本题的关键是要知道固体质量的减少量就是生成二氧化碳的质量;根据气体的质量算出碳酸钙的质量,再计算质量分数即可.


科目:初中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | CO | C. | Fe | D. | CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化合物是由不同种元素组成的,所以由不同种元素组成的一定是化合物 | |
| B. | 活泼金属中滴加稀盐酸有气泡产生,滴加稀盐酸有气泡的物质一定是活泼金属 | |
| C. | 碱的溶液能够使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱 | |
| D. | 含有氢元素的化合物完全燃烧可生成水,所以燃烧生成水的物质中一定有氢元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
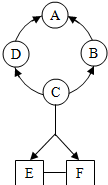 如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
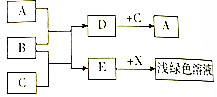 已知A、B、C、D、E为初中常见物质,B为红棕色固体,它们之间存在如图转化关系:(图中“→”表示物质间存在的转化关系,部分产物已略去)
已知A、B、C、D、E为初中常见物质,B为红棕色固体,它们之间存在如图转化关系:(图中“→”表示物质间存在的转化关系,部分产物已略去)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
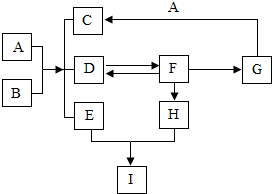 如图表示的是初中几种常见物质的转化关系(部分反应物、生成物及反应条件省略),已知C为生活中不可缺少的调味品,F为大理石的主要成分,请回答以下问题:
如图表示的是初中几种常见物质的转化关系(部分反应物、生成物及反应条件省略),已知C为生活中不可缺少的调味品,F为大理石的主要成分,请回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 38.9% | B. | 56% | C. | 44% | D. | 61% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 氢氧化钠溶液 | C. | 碳酸钠溶液 | D. | 氢氧化钙溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com