
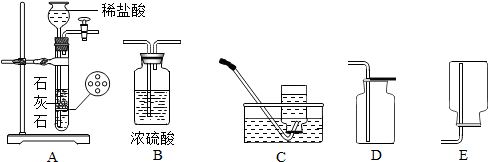
 工业上采用氨碱法生产纯碱(Na2CO3),主要流程:
工业上采用氨碱法生产纯碱(Na2CO3),主要流程:分析 (1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
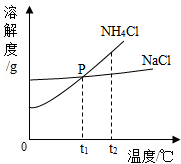
(2)物质的溶解度曲线交点表示物质的溶解度在该温度下相等;
饱和溶液溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
一种物质的溶解度受温度变化影响较大,一种物质的溶解度受温度变化影响较小,可以用降温结晶的方法分离.
解答 解:(1)在①〜③三个过程中,发生分解反应的是③,即碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故填:③;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)①P点表示的意义是t1℃时NH4Cl和NaCl的溶解度相等.
故填:t1℃时NH4Cl和NaCl的溶解度相等.
②将t2℃时NH4Cl饱和溶液的温度降到t1℃时仍然是饱和溶液,由于溶解度减小,因此溶液中NH4Cl的质量分数会变小.
故填:变小.
③当NH4Cl固体中含有少量NaCl时,可采用降温结晶的方法提纯NH4Cl,提纯的原理是:NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大.
故填:NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
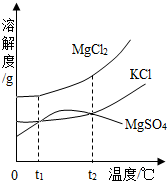
| A. | 该条件下NaHCO3的溶解度比NH4C1的大 | |
| B. | 析出晶体后的溶液为NaHCO3的不饱和溶液 | |
| C. | 在加压的条件下向饱和氨盐水中通二氧化碳,能加速NaHCO3的生成 | |
| D. | 析出晶体后剩余溶液中只有一种溶质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 食盐在生活中具有广泛的用途.
食盐在生活中具有广泛的用途.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | HCl、H2SO4 | B. | NaOH、Cu(OH)2 | C. | FeCl3、Na2CO3 | D. | CO2、Fe3O4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生产沉淀的总质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 合理使用化肥和农药有利于保护水资源 | |
| B. | 食品袋内充入氮气能延缓食品变质 | |
| C. | 煤气泄露时点燃蜡烛检查 | |
| D. | 减少燃煤量以防止酸雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
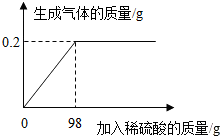 欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.
欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
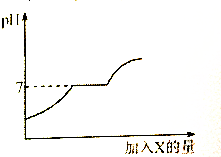 现有盐酸和Ca(NO3)2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和Ca(NO3)2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 氢氧化钠溶液 | C. | 碳酸钠溶液 | D. | 稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com