
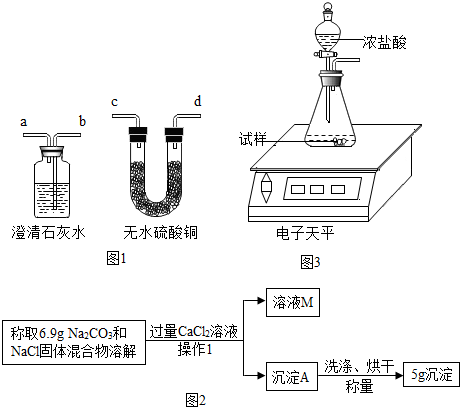
| 实验步骤 | 实验现象 | |
| 实验1 | 取安多夫样品少许加入试管中,加入醋酸,并把产生的气体通入澄清石灰水 | 产生气泡,澄清石灰水变浑浊 |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
分析 【实验探究一】
检验二氧化碳和水蒸气时,应该先检验水蒸气,后检验二氧化碳;
醋酸和碳酸氢钠反应生成产生钠、水和二氧化碳;
过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗;
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳.
解答 解:【实验探究一】
1.用右图1实验装置进行验证时,应该先检验水蒸气,后检验二氧化碳,装置导气口连接顺序是:气体样品→c→d→b→a.
故填:c;d;b;a.
2.猜测①:二氧化碳可能是由醋酸和碳酸氢钠反应产生的.
故填:醋酸和碳酸氢钠反应产生的.
针对以上猜测,小于设计了以下实验:
| 实验步骤 | 实验现象 | |
| 实验1 | 取安多夫样品少许加入试管中,加入醋酸,并把产生的气体通入澄清石灰水 | 产生气泡,澄清石灰水变浑浊 |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质都是由分子构成的 | |
| B. | 分子可以分成原子,但原子不能再分 | |
| C. | 原子都是由原子核和核外电子构成的 | |
| D. | 原子核都是由质子和中子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ①向一定量稀盐酸中加水稀释 | |
| B. | ②一定温度下,向水中加入硝酸钾晶体 | |
| C. | ③加热一定量的高锰酸钾固体 | |
| D. | ④向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com