
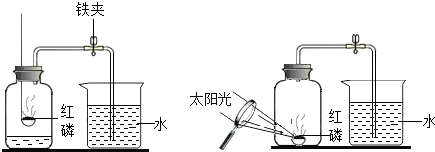
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:初中化学 来源: 题型:
 20、某无色气体中只含有碳、氧两种元素,一组同学用如图所示的实验来探究该气体的成分,实验中观察到黑色固体逐渐变成红色,澄清的石灰水变浑浊.
20、某无色气体中只含有碳、氧两种元素,一组同学用如图所示的实验来探究该气体的成分,实验中观察到黑色固体逐渐变成红色,澄清的石灰水变浑浊.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?高淳县一模)小沁同学用如图所示装置测定某纯碱样品(杂质为NaCl)中Na2CO3的质量分数.C为有刻度的玻璃仪器,可装合适的液体,根据液面位置变化测定气体体积.
(2012?高淳县一模)小沁同学用如图所示装置测定某纯碱样品(杂质为NaCl)中Na2CO3的质量分数.C为有刻度的玻璃仪器,可装合适的液体,根据液面位置变化测定气体体积.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
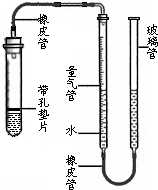 某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省苏州市立达中学九年级(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com