
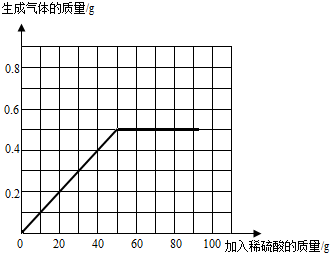
| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量 /g |
50.0 | 50.0 | 50.0 | 50.0 |
| 加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |

| 65 |
| x |
| 2 |
| 0.5g |
| 16.25g |
| 50g |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:初中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
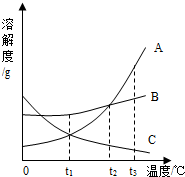 (2012?南宁)右图为A、B、C三种固体物质的溶解度曲线,回答下列问题:
(2012?南宁)右图为A、B、C三种固体物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
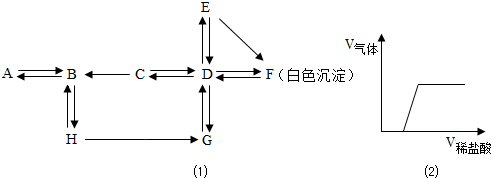
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有 C(碳) C(碳) |
| (2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | 有白色沉淀生成 有白色沉淀生成 |
燃烧产物中肯定有Na2CO3 |
| (3) | 取(2)所得少量上层清液,加入 酚酞 酚酞 溶液 |
溶液变成红色 | 燃烧产物中肯定有 Na2O Na2O |
查看答案和解析>>
科目:初中化学 来源: 题型:
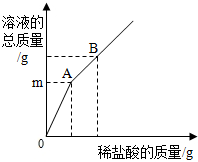 (2012?南宁二模)某同学取20克溶质质量分数为 8%的 Na0H 溶液加入烧杯中,用溶质质量分数为7.3%的稀盐酸中和.消耗稀盐酸的质量与烧杯中溶液总质量关系如图所示,已知A点溶液呈中性,则:
(2012?南宁二模)某同学取20克溶质质量分数为 8%的 Na0H 溶液加入烧杯中,用溶质质量分数为7.3%的稀盐酸中和.消耗稀盐酸的质量与烧杯中溶液总质量关系如图所示,已知A点溶液呈中性,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com