
某班多个化学兴趣小组,在学习碱的化学性质时,进行了如图1所示的实验.
(1)小明组反应后A中溶液呈红色,则反应后溶液中的溶质是(酚酞除外) ;小红组做完A实验后溶液呈无色,用微观理论解释变无色的反应的实质 .
(2)小红组做B实验用于确认二氧化碳与氢氧化钠能发生化学反应(实验前K1、K2均处于关闭状态).B实验全过程的操作及现象 .请写出氢氧化钠与二氧化碳反应的化学方程式 .
(3)实验结束后,小军将以上同学做的A、B两个实验的废液均倒入同一个大烧杯中,观察到混合后的废液呈红色,由此产生疑问.
[提出问题]大烧杯的废液中含有哪些溶质?(酚酞除外)
[查阅资料]氯化钙溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验验证]取一定量的废液,逐滴加入氯化钙溶液,如图2为同学们根据部分实验现象绘制的关系曲线.
[实验结论]如果观察到的现象只有沉淀产生,溶液仍然为红色,则废液中的溶质为 ;
如果观察到 ,则废液中的溶质为 .
(1)NaCl NaOH;H+和OH﹣结合成为H2O分子;(2)打开K1,气球逐渐鼓起(变大),(关闭K1),打开K2,有大量气泡产生,且气球逐渐变瘪(变小);2NaOH+CO2=Na2CO3+H2O;(3)NaCl,Na2CO3 NaOH;有白色沉淀产生,且红色消失,NaCl,Na2CO3.
解析试题分析:(1)反应后A中溶液呈红色,说明溶液显碱性,即氢氧化钠过量,氢氧化钠与盐酸反应生成氯化钠和水,所以反应后的溶液中的溶质是氯化钠和氢氧化钠;盐酸电离出的氢离子和氢氧化钠电离出来的氢氧根离子反应生成水,溶液不显碱性了,红色就褪去;(2)打开K1时,氢氧化钠和二氧化碳反应,生成碳酸钠和水,使瓶内压强减小,在大气压的作用下,气球鼓起,打开K2时,盐酸与反应生成的碳酸钠反应生成二氧化碳,使瓶内的压强增大,小气球重新变瘪;氢氧化钠与二氧化碳反应的反应物是氢氧化钠和二氧化碳,写在等号的左边,生成物是碳酸钠和水,写在等号的右边,用观察法配平即可,所以方程式是:2NaOH+CO2=Na2CO3+H2O.(3)由图示可知从一开始就有白色沉淀产生,所以溶液中一定含有碳酸钠,又因为盐酸与氢氧化钠反应生成了氯化钠,碳酸钠和盐酸反应生成了氯化钠,所以溶液中还含有氯化钠,氯化钙反应完还显红色,说明溶液中还含有氢氧化钠,所以如果观察到的现象只有沉淀产生,溶液仍然为红色,则废液中的溶质为NaCl,Na2CO3 NaOH;如果观察到有白色沉淀生成,红色消失,说明溶液中含有氯化钠、碳酸钠,不含有氢氧化钠.
考点:碱的化学性质.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:探究题
同学们对实验“煅烧石灰石”展开深入探究。
(1)煅烧石灰石。可观察到石灰石的表面 。
(2)为证明石灰石已分解,三位同学从其他角度设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式__ __。
II.乙同学按图二所示进行试验,观察到B中液体变 色,A中实验的作用 。
III.丙同学取一块石灰石进行煅烧,一段时间后发现固体质量减轻mg(即CO2的质量),证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 _ 。
(3)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生mg气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙 _ mol(用m表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 86.3g | 284.2g |
| 反应后质量 | 83.9g | 286.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
水滑石化学式为:[Mg6Al2(OH)16CO3]?4H2O(相对分子质量为602),是环保型阻燃剂,它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
[查阅资料]水滑石与稀硫酸反应的化学方程式为:[Mg6Al2(OH)16CO3]?4H2O+9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O,药片中除了水滑石外含有一定量的辅料﹣﹣淀粉等物质。
[提出猜想]小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
[设计方案]他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了如图所示的实验装置.取10.0g市售的水滑石药片研磨成粉末,进行实验。
[说明]碱石灰是氧化钙和氢氧化钠固体的混合物,B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %.(写出计算过程)。
[方案评价]在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
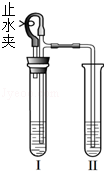
用如图所示装置分别进行两个实验(已知:氯化钙溶液呈中性).
(1)打开止水夹,向Ⅰ中液体加入一种黑色固体、Ⅱ中液体加入一种白色固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体内出现燃烧现象.
①写出燃烧反应的化学方程式 .
②请说明Ⅱ中出现燃烧的原因 .
(2)打开止水夹,向Ⅰ中液体加入一小块固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体出现浑浊现象.关闭止水夹,发现Ⅱ中液面上升,溶液由浑浊变澄清.
①请说明溶液由浑浊变澄清的原因 .
②若实验后Ⅱ中澄清液中的溶质由一种或两种物质组成,为检验其成分,应该进行的实验操作是
.
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某学习小组对在实验中吸收过二氧化碳气体的碱石灰成分进行了研究.
【查阅资料】
①碱石灰是CaO与NaOH 的固体混合物,通常用于吸收二氧化碳及干燥气体.
②碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
【提出猜想】
该碱石灰的主要成分可能含有 、Ca(OH)2、CaCO3、NaOH和 .
【设计方案、收集证据】
(1)甲同学在烧杯中放入少量的碱石灰样品,加入足量蒸馏水充分搅拌,静置有白色沉淀,甲同学认为样品中一定含有CaCO3,乙同学认为他的结论不准确,原因是: (填化学方程式).
(2)乙同学进一步设计实验并进行验证,过程如下:
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 溶液. | 有白色沉淀生成 | 生成白色沉淀的化学方程式为: . |
| ②过滤,向滤液中滴加无色酚酞试液. | 无明显现象 | 通过实验及分析,样品中不含有: . |


查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小明同学在一本化学资料中发现KClO3晶体在MnO2的催化下,能分解生成O2和氯化钾,于是提出疑问,CuO能催化KClO3的受热分解反应吗?于是设计了以下实验:
[实验方案] ①任取2份氯酸钾,分别放于两支试管中,仅向其中一支试管中加入m克CuO; ②将上述盛有KClO3的两支试管,在相同条件下同时加热,并使产生的气体通入水中,观察产生气泡的速率 , 比较产生气体的速率;③充分反应后冷却,将放入CuO的试管内固体残余物加水溶解,滤出不溶物,洗涤并干燥; ④观察滤出固体物质的颜色状态为黑色固体。 ⑤将滤出固体与碳粉混合后,在密闭容器中加热,将所产生的气体通过澄清石灰水,观察现象黑色固体变为红色,石灰水变浑浊 。
[交流讨论] (1)步骤:①②的目的是通过对比实验,探究
在第三步过滤操作中用到的玻璃仪器为 、 、
(3)步骤⑤的目的是证明
(4)小红认为小明实验中有缺陷,请你帮小红改进实验中的不足之处: 、
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈 性,还可能呈 性。
【实验验证】
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
已知废旧普通干电池筒内主要有C、淀粉、MnO2、ZnCl2、NH4C1等物质,某化学兴趣小组同学欲通过实验从中回收MnO2,并研究MnO2在分解过氧化氢制氧气的反应中所起的作用。
【查阅资料】淀粉不溶于冷水,完全燃烧生成二氧化碳和水;碳、二氧化锰不溶于水。
ZnCl2、NH4Cl均易溶于水。
【进行实验】实验步骤如下图:
|
 步骤b所对应的操作名称是 ,其中玻璃棒所起的作用是 ;
步骤b所对应的操作名称是 ,其中玻璃棒所起的作用是 ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com