
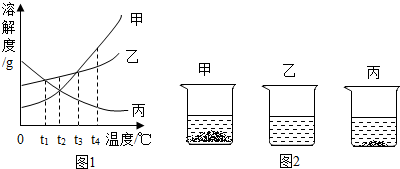
分析 (1)根据固体物质的溶解度曲线解答;
(2)根据在t2℃时,甲丙物质的溶解度解答;
(3)根据溶解度曲线可以判断物质的溶解度随温度的变化特点以及溶解度大小的关系,据此解答.
解答 解:(1)t3℃时,乙的溶解度大于丙,故将等质量的乙和丙分别配成饱和溶液,所用水的质量关系是乙<丙;
(2)据饱和时质量分数的计算式$\frac{溶解度}{100g+溶解度}$×100%可知:溶解度大则溶质的质量分数大,t1℃时甲丙的溶解度是:甲<丙,所以甲、丙两种物质的饱和溶液溶质的质量分数甲<丙;将t1℃的甲、丙两种物质的饱和溶液升温到t2℃时,甲溶液中溶质、溶剂的质量不变,溶质的质量分数不变,而丙的溶解度减小,会有晶体析出,但t2℃时丙的溶解度大于甲,故所得溶液中溶质质量分数的关系仍为为甲<丙.
(3)20℃时,把等质量的甲、乙、丙三种固体分别加入到盛有50g水的烧杯中,充分溶解后,所得现象如图2,分析可知,20℃时,三种物质的溶解度大小为乙>丙>甲,由图象可知:20℃所处的温度范围是t1<20<t2.
答案:(1)<;(2)<;(3)B
点评 本题难度不是很大,主要考查了固体溶解度曲线所表示的意义,并根据溶解度曲线解决相关的问题.掌握溶解度曲线的意义和应用是正确解答本题的关键.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 为了提高粮食产量,农业上应多使用农药和化肥 | |
| B. | 将垃圾填坑改为露天焚烧,以减少土地的占用和对地下水的污染 | |
| C. | 推广新能源汽车,努力提高空气质量 | |
| D. | 为了提高居民健康水平,大力提倡长期饮用蒸馏水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ca(OH)2溶液 | B. | NaOH溶液 | C. | 稀盐酸 | D. | 稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 123 | B. | 153 | C. | 323 | D. | 336 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 可燃物 | 红磷 | 木炭 | 硫 | 蜡烛 | 铁丝 |
| 氧指数 | 0.5% | 4% | 4.5% | 5%~6% | 60% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,小王同学对“双氧水分解快慢的影响因素”进行了探究.
实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,小王同学对“双氧水分解快慢的影响因素”进行了探究.| 实验编号 | 温度℃ | 二氧化锰的形状(均取0.4cm) | 收集到氧气的体积/mL(时间均为10s) |
| ① | 20 | 颗粒状 | a |
| ② | 30 | 粉末状 | b |
| ③ | 30 | 颗粒状 | c |
| ④ | 20 | 粉末状 | d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com