
分析 分析题中所发生的变化可知,反应放出氢气造成反应前后物质总质量不相等,因此,利用质量守恒先计算出恰好完全反应时所放出氢气的质量;然后根据反应放出氢气的质量计算反应的锌和硫酸的质量及生成硫酸锌的质量;接下来由锌片质量与锌质量差求得氧化锌,由氧化锌计算反应生成的硫酸锌和消耗的酸;两部分硫酸锌的质量与反应后所得溶液的质量比计算生成物溶液中溶质的质量分数,两部分酸可计算硫酸的溶质质量分数,据此分析解答即可.
解答 解:根据质量守恒定律,反应生成氢气的质量=14.6g+200g-214.4g=0.2g
设锌片中单质锌的质量为x,反应生成硫酸锌的质量为y,反应的硫酸的质量是z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x z y 0.2g
$\frac{65}{x}$=$\frac{98}{z}$=$\frac{161}{y}$=$\frac{2}{0.2g}$
x=6.5g y=16.1g z=9.8g
锌片中的氧化锌的质量=14.6g-6.5g=8.1g
设锌片中氧化锌与硫酸完全反应生成硫酸锌的质量为w,反应的硫酸的质量为n
ZnO+H2SO4═ZnSO4+H2O
81 98 161
8.1g n w
$\frac{81}{8.1g}$=$\frac{98}{n}$=$\frac{161}{w}$
w=16.1g n=9.8g
(1)原稀H2SO4中溶质的质量分数为:$\frac{9.8g+9.8g}{200g}$×100%=9.8%;
(2)生成物溶液中溶质的质量分数=$\frac{16.1g+16.1g}{214.4g}$×100%≈15%;
(3)此锌片在被氧化前的质量为:6.5g+$\frac{65}{81}$×8.1g=13g.
答:(1)原稀H2SO4中溶质的质量分数为9.8%;
(2)生成物溶液中溶质的质量分数为15%;
(3)此锌片在被氧化前的质量是13g.
点评 解答本题时需要注意到锌片氧化后的氧化锌也能与硫酸反应,且生成硫酸锌.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| 选顼 | 物质 | 杂质(少量) | 试剂或方法 |
| A | H20 | 色素 | 活性炭 |
| B | Mn02 | KCl | 溶解、过滤、洗涤、烘干 |
| C | N2 | 02 | 通过红热的木炭 |
| D | C02 | CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
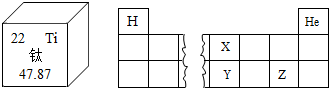
| A. | 钛元素的相对原子质量为47.87g | B. | 钛元素的核内中子数为22 | ||
| C. | Z的原子序数小于X | D. | Z和Y处于同一周期 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | CO2气体 | CO气体 | 通入氧气,点燃 |
| B | NaCl溶液 | Na2CO3溶液 | 滴入适量稀盐酸至无气泡产生 |
| C | Fe粉 | CuO粉 | 加入足量稀盐酸充分反应后过滤 |
| D | Cu(NO3)2溶液 | AgNO3溶液 | 加足量铜粉充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ②③①④ | C. | ②①③④ | D. | ①③②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com