
分析 根据质量守恒定律可知试管内物质质量的减少量就是生成的氧气的质量,根据方程式以及氧气的质量,列比例式计算出参加反应的氯酸钾的质量,进而计算原混合物中氯酸钾的质量分数.
解答 解:(1)由于是完全反应,根据质量守恒,减少的质量就是生成的氧气的质量,即制得氧气:30g-20.4g=9.6g;标准状况时,氧气的体积为$\frac{9.6g}{1.43g/L}$=6.7L
(2)设氯酸钾质量为x.
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 9.6g
$\frac{245}{x}$=$\frac{96}{9.6g}$
x=24.5g
原混合物中氯酸钾的质量分数$\frac{24.5g}{30g}$×100%=81.7%
答:(1)完全反应后制得氧气9.6g;标准状况时体积为6.7L;
(2)混合物中氯酸钾的质量分数是81.7%.
点评 本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量进行进一步计算.


科目:初中化学 来源: 题型:解答题
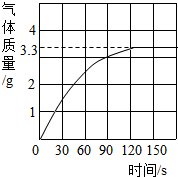 某校化学兴趣小组同学为了测定当地矿山石灰石中碳酸钙的含量,将足量的稀盐酸加入到10g石灰石中,产生CO2气体的情况如图所示:
某校化学兴趣小组同学为了测定当地矿山石灰石中碳酸钙的含量,将足量的稀盐酸加入到10g石灰石中,产生CO2气体的情况如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
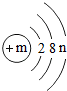 某粒子(原子或离子)的结构示意图为,请回答下列问题:
某粒子(原子或离子)的结构示意图为,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电器着火应先切断电源 | |
| B. | 扑灭森林火灾的有效方法之一,是将大火蔓延路线前的一片树木砍掉 | |
| C. | 图书馆内图书起火,立即用泡沫灭火器扑灭 | |
| D. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH BaCl2 MgCl2 | B. | MgCl2 NaSO4 Ba(OH)2 | ||
| C. | KOH BaCl2 CuSO4 | D. | AgNO3 Cu(OH)2 ZnCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
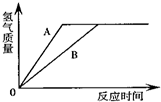 有等质量的A(铁)、B(锌)两金属,将A、B放入质量分数为15%的稀硫酸中,产生氢气的质量随反应时间变化曲线如图.下列说法正确的是( )
有等质量的A(铁)、B(锌)两金属,将A、B放入质量分数为15%的稀硫酸中,产生氢气的质量随反应时间变化曲线如图.下列说法正确的是( )| A. | 产生氢气的速率A<B | B. | 反应后A、B一定都有剩余 | ||
| C. | 消耗的稀硫酸质量一定相等 | D. | 消耗B的质量一定小于A的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com