
| 反应时间/min | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | |
| 烧杯及所盛物质总质量/g | 300.0 | 299.0 | 298.0 | 297.2 | 296.5 | 296.0 | 295.7 | 295.6 | m | 295.6 |
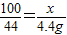 ,
, =10g;
=10g; ×100%=83.3%.
×100%=83.3%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:2007年福建省泉州市永春县初中学业质量检查化学试卷(解析版) 题型:填空题

| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁抗锈蚀性能不如不锈钢. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com