
【题目】某化学兴趣小组的同学对空气中氧气含量的测定进行实验探究。
(观察与记录)
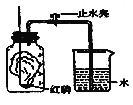
(1)按如图所示装置和药品进行实验,实验中可观察到的现象是:
①集气瓶内________________________;
②待装置冷却到室温打开止水夹,__________。
(讨论与交流)(2)若用铁丝代替红磷测定空气中氧气的含量,小明同学认为不可以,其原因是_______________,若用木炭代替红磷,小丽同学认为也不可以,其原因是____________
(分析与思考)(3)小芳同学用镁条代替红磷来测定空气中氧气的含量,结果却发现倒吸的水量远远超过集气瓶的1/5。小组内同学帮她仔细检查,发现装置的气密性及操作步骤均无问题。你认为造成此现象的原因可能是____________
(归纳与总结)(4)小组内同学反思上述实验的探究过程后认为:若用燃烧法测定空气中氧气含量,在药品的选择或生成物的要求上应考虑的是_______、______。(写出两条即可)
【答案】产生白烟 水进入集气瓶约占集气瓶中空气总体积的五分之一 铁在空气中不能燃烧 木炭燃烧生成二氧化碳,导致水不能进入集气瓶 空气中的氮气、氧气都能和镁反应 反应物是固体,只能和氧气反应 生成物是固体
【解析】
磷燃烧能够消耗空气中的氧气,氧气消耗后,容器中的气压减小,在外界大气压作用下,水进入容器,进入容器中的水的体积即为容器中空气中的氧气体积,进一步可以计算出空气中氧气的含量。
(1)①集气瓶内红磷燃烧,产生白烟;
②待装置冷却到室温打开止水夹,水进入集气瓶约占集气瓶中空气总体积的五分之一;
(2)若用铁丝代替红磷测定空气中氧气的含量,小明同学认为不可以,其原因是铁在空气中不能燃烧;若用木炭代替红磷,小丽同学认为也不可以,其原因是木炭燃烧生成二氧化碳,导致水不能进入集气瓶;
(3)造成此现象的原因可能是空气中的氮气、氧气都能和镁反应;
(4)若用燃烧法测定空气中氧气含量,在药品的选择或生成物的要求上应考虑的是:反应物是固体,只能和氧气反应,生成物是固体。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
(设计实验)用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。

(进行实验)该小组按上述实验设计,在一定温度下进行了实验。实验开始时,先向装置通一会儿一氧化碳,然后再加热,目的是_________。
实验过程中测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
(分析与讨论)
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
(查阅资料)
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
(实验与猜想)
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ____________。
(2)进行猜想:黑色固体粉末可能有三种:
a.全部为铁 b.全部为四氧化三铁c._________。
(3)通过实验中获得的数据进行计算,得出结论:猜想 _________。
(填“a”“b”或“c”)正确.
(4)实验装置图中采用虚线框内的装置,其作用有 ___________。
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室制取气体的常用装置。

(1)A中的试管口为什么应略向下倾斜?______
(2)写出选用B制取氧气的化学方程式。______
(3)若采用C(气体由a口进入)收集到一种不易溶于水的气体,请简述验证该气体的实验方法______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学基础与常识
(1)以下用品中,主要利用金属导电性的是________(填字母序号)。
A.铝箔  B.铜导线
B.铜导线 C.炒锅
C.炒锅
(2)某密闭容器中物质变化过程的微观示意图如下:

A、B、C中表示混合物的是_____(填序号)。
(3)软玉也称“中国玉”,以新疆“和田玉”为代表。生成“和田玉”矿床的反应方程式为:5CaMg(CO3)2+8SiO2+X====Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3CaCO3,则X的化学式为_____________。
(4)工业上制金属钛采用金属热还原法还原四氯化钛。将钛铁矿和炭粉混合加热进行氯化处理,并使生成的TiCl4在高温下用熔融的镁在氩气中反应可得多孔的海绵钛,这种海绵钛经过粉碎、放入真空电弧炉里熔炼,最后制成各种钛材。下图为某化工企业生产流程示意图:
 9.
9.
请写出③中反应的化学方程式__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观一微观”之间建立联系,是学习化学必备的思维方式。下图是某反应的微观示意图,下列说法正确的是
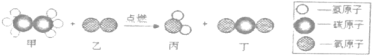
A. 该反应不遵守质量守恒定律
B. 参加反应的甲、乙的质量比为15:56
C. 反应生成丙、丁分子个数比为1:1
D. 该反应中甲、乙、丙、丁都属于化合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氨气易溶于水,易与浓硫酸反应,不与碱石灰(干燥剂)反应.氨气还具有还原性,在加热的条件下能还原氧化铜:2NH3+3CuO![]() N2+3Cu+3H2O,某化学兴趣小组同学设计下图所示实验来验证氨气的组成(图中夹持、固定装置部分均略去).已知整套装置气密性良好,且实验中所用试剂均足量,B、D、E中所装药品能完全吸收相关物质.实验前装置 C、D 的质量分别为 mC1、mD1.
N2+3Cu+3H2O,某化学兴趣小组同学设计下图所示实验来验证氨气的组成(图中夹持、固定装置部分均略去).已知整套装置气密性良好,且实验中所用试剂均足量,B、D、E中所装药品能完全吸收相关物质.实验前装置 C、D 的质量分别为 mC1、mD1.

实验步骤:
Ⅰ.连接装置A、B、C、D、E,打开分液漏斗旋塞注入足量浓氨水后关闭旋塞.通入氨气一段时间后,接着连接装置F.
Ⅱ.点燃酒精灯加热,待黑色固体变为红色后,停止加热.
Ⅲ.继续通氨气至玻璃管冷却.
Ⅳ.记录量气管读数为V mL.
V.称量装置 C、D 的质量分别为 mC2、mD2.
请回答下列问题:
(1)装置A中NaOH固体所起的作用,是利用了该物质的____性质.
(2)若 mC1﹣mC2=(mD2﹣mD1)×____,则可证明氨气的组成中不含氧元素.
(3)步骤Ⅲ通入氨气的目的之一是____.
(4)如果略去装置B,导致的后果是____.
①装置C中会发生新的化学反应
②会得出“氨气的组成中含有氧元素”的结论
③使测得的氨气组成中N、H元素质量比偏大
(5)为减小误差,在读取量气管读数前必须进行的操作是____.
(6)步骤Ⅱ中氧化铜是否完全反应,对实验结果____(填“有”、“没有”或“不确定有没有”)影响.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有广泛应用,某化学研究性学习小组设计并完成了如下实验。
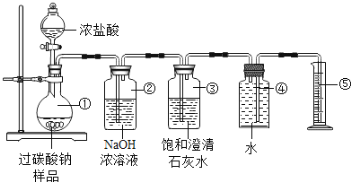
(实验目的)测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)中过碳酸钠的质量分数
(实验原理)2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
(实验装置)如图(装置气密性良好且试剂均足量)
(交流与讨论)
(一)甲同学认为测量产物中O2的体积即可测定样品中过碳酸钠的质量分数。
(1)写出装置②中发生反应的化学方程式:__________________;(写一个即可)
(2)判断二氧化碳全部被装置②吸收的依据是:____________________________;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积约为vL(已知该实验条件下氧气的密度为ρg/L),则称取的样品质量应大于_______ g;
(二)乙同学认为测量产物中CO2的质量(即反应前后装置②的质量差)就可测定样品中过碳酸钠的质量分数。利用上述实验装置测得CO2的质量并计算样品中过碳酸钠的质量分数,结果会偏高,原因可能是____________________;
(三)丙同学提出了一种新方案,得到了大家的一致认可:称取样品质量为m,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发结晶、干燥,称得氯化钠固体质量为n。则该样品中过碳酸钠的质量分数为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色固体可能含碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。某化学兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。请回答下列问题:
(1)BC段可观察到的现象是_____,从C到D液体的pH_____(填“增大”、“减小”或“不变”);
(2)原白色固体中一定含有_____,一定不含有_____;
(3)D点时,溶液中一定含有的溶质是_____;
(4)为进一步探究该白色固体的成分,该组同学取少量D点的溶液于试管中,加入_____,观察有无的现象,则可证明白色固体的成分。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为A、B、C三种物质的溶解度曲线,据图回答下列问题:
(1)A、B、C三种物质中最有可能是气体的是________
(2)将t℃时三种物质等质量的饱和溶液分别降温到0 ℃时,析出溶质最多的是________。
(3)20 ℃ 时,将30gA物质放入50g水中,充分搅拌,所得溶液的质量是________g
(4)若将t1℃三种物质的饱和溶液分别升温到t2 ℃,则三种溶液中溶质的质量 分数由大到小的顺序为________________
(5)若要提纯含少量B杂质的A物质,应该采用的提纯方法是________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com