
 金属是重要的资源,在日常生活中已得到越来越广泛的应用.
金属是重要的资源,在日常生活中已得到越来越广泛的应用.分析 (1)根据同的性质和用途分析;
(2)根据纯铝和铝合金的硬度分析;
(3)根据防止生锈的原理分析回答;
(4)根据在金属活动性顺序中,排在前面的金属可以把位于它后面的金属从其盐溶液中置换出来,可简记为“前置后,盐可溶”进行分析.
解答 解:(1)铜常用于制作导线,因为其具有良好的导电性.
(2)将纯铝和铝合金相互刻画,纯铝上留下明显划痕,说明铝合金的硬度大于纯铝的硬度.
(3)对汽车部分钢铁部件进行喷漆可以防止其生锈,原因是隔绝氧气和水;
(4)在金属活动顺序表中,金属的活动性顺序是锌>铜>银.向一定量AgNO3溶液中加入铜和锌的混合粉末时,锌先与硝酸银反应,当锌反应完后,铜再与硝酸银反应.
①若乙中含有锌、铜、银三种固体,说明了溶液中没有硝酸银、硝酸铜,则溶液甲中所含的金属离子符号为:Zn2+,此时向固体乙中加入稀盐酸,锌能与发生反应,化学方程式为:Zn+2HCl═ZnCl2+H2↑,该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物,属于置换反应;
②若溶液甲显蓝色,说明了铜与于硝酸银反应生成了硝酸铜,化学方程式为:Cu+2AgNO3═2Ag+Cu(NO3)2,此时固体乙中一定含有的物质是银.
故答案为:(1)掉电性;(2)铝合金的硬度大于纯铝的硬度;(3)隔绝氧气和水;(4)①Zn2+,Zn+2HCl═ZnCl2+H2↑,置换;②Cu+2AgNO3═2Ag+Cu(NO3)2,银.
点评 本题考查了金属活动性顺序的应用,难度不大,完成此题,可以依据金属活的知识分析回答.


科目:初中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ①②④⑤⑥ | C. | ①③④⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
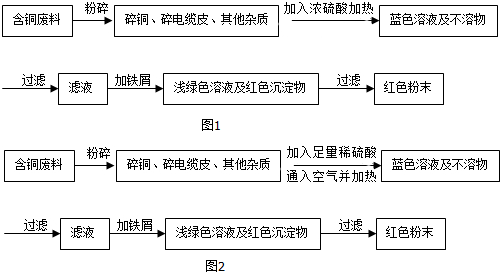
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
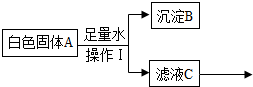
| 实验操作 | 现象 | 结论 |
| 向滤液C中加入足量的氯化钡溶液,充分反应后,静置,取上层清液滴加无色酚酞 | 无色酚酞变红色 | A中有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
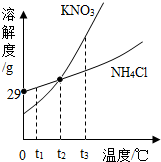
| A. | t1℃时用等质量的固体配制饱和溶液,NH4Cl溶液质量更大 | |
| B. | t2℃时两种饱和溶液中溶质的质量分数一定相等 | |
| C. | t3℃时KNO3的溶解度大于NH4Cl的溶解度 | |
| D. | 两种饱和溶液从t2℃降到t1℃时,均有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+ SO42- K+ CO32- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | Fe3+ SO42- H+ Cl- | D. | Na+ Ba2+ NO3- SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com